
题目列表(包括答案和解析)
20、(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。
如H(g)+I(g)→H-I(g),△H=-297KJ/mol即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。下表是一些键能数据(KJ·mol-1):
|
|
键能 |
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
回答下列问题:
⑴由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。试预测C-Br键的键能范围 。
⑵①由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 ;
②由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ·mol-1以及表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
⑶瑞士化学家盖斯(Hess G.H)在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ·mol-1
①请写出CO还原FeO的热化学方程式:
;
②根据以上信息,你认为“Hess定律”在我们确定一些化学反应的反应热时有何重要意义 。
19、(8分)实验室利用如右图装置进行中和热的测定。回答下列问题:
⑴该图中有两处未画出,它们是 、 ;
⑵在操作正确的前提下提高中和热测定的准确性的关键是:
;
⑶如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出
的“中和热”将 (填“偏大”、“偏小”、“不变”);原
因是 。
18、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是

A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C、T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C
反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
 第Ⅱ卷(非选择题,共78分)
第Ⅱ卷(非选择题,共78分)
17、已知450℃时,反应H2(g)+I2(g) 2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C、100 D、无法确定
16、有甲、乙两瓶醋酸溶液,测得甲的PH=a,乙的PH=a+1,下列推断正确的是
A、物质的量浓度C甲是C乙的10倍
B、甲溶液中c(OH-)是乙中c(OH-)的10倍
C、由水电离产生的c(H+)乙是甲的10倍
D、与等量的NaOH反应,消耗甲、乙两酸的体积V乙>10V甲
15、在一定温度下有PH均为2的X、Y、Z三种不同的
一元酸各5mL,分别加水稀释到5000mL,其pH与
溶液体积(V)的关系如图所示,下列说法正确的是
A、稀释后X溶液中水的电离程度最小
B、三种酸的原来的浓度大小为X<Y<Z
C、若X、Y、Z都是弱酸,则a的值一定小于5
D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积V(X)>V(Y)
14、针对反应:Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O及其相关稀溶液间的实验,下列分析正确的是(已知Na2S2O3中S的化合价有两种)

A、Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓ + H2O

B、Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓ + H2O
C、在研究温度对化学反应速率影响的实验中,反应速率通常是依据氧化产物生成的快慢来确定
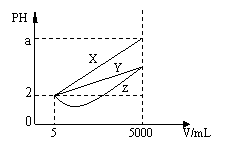 D、在研究温度对化学反应速率影响的实验中,反应速率通常是依据还原产物生成的快慢来确定
D、在研究温度对化学反应速率影响的实验中,反应速率通常是依据还原产物生成的快慢来确定
13、25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=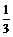 y,则x值为
y,则x值为
A、2 B、3 C、4 D、5
12、一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内压强比起始时增大了20%,则容器中可能发生的反应是
A、2A+B 2C B、A+B
2C B、A+B 2C
2C
C、2A+B C D、A+B
C D、A+B 3C
3C
11、下列有关说法不正确的是
A、催化剂的使用能降低反应所需的能量,并提高活化分子百分数
B、燃烧热是指可燃物在氧气中完全燃烧所放出的热量
C、熵变和焓变对体系影响可表示为:△G=△H-T*△S,当△H<0,△S>0时,该反应可自发进行
D、人们在洗发时,使用的护发素可起到调节头发PH值的作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com