
题目列表(包括答案和解析)
3、一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( )
A.υ(正、A2)= υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
2、在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是( )
A、3.6mol B、3.2mol C、2.8mol D、1.6mol
1、根据热化学方程式(在101kPa时)∶
S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中不正确的是( )
A.S的燃烧热为297.23kJ/mol
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(g) + O2(g) = SO2(g) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的总能量大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的总能量
26.(6分)在容积为10L的密闭容器中,通入40molN2和120molH2,在一定条件下进行反应,
2秒后达到平衡状态,此时N2的浓度为2mol/L。试求:
(1)用H2浓度表示的2秒内的平衡反应速率;
(2)N2的转化率;
25.(6分)将31.64g铜与140mL某浓度的硝酸反应,铜完全溶解,产生的NO和NO2混
合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
24.(9分)实验室常见到如下图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃
短柄,用该仪器可进行多项实验,当玻璃管内装有碘晶体时,用此仪器可进行碘升华实
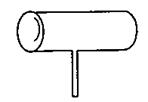 验,具有装置简单,操作方便,现象明显,无污染,可反复使用等优点。
验,具有装置简单,操作方便,现象明显,无污染,可反复使用等优点。
(1)用此仪器不能反复进行的实验是 (填写编号)
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷互相转化
D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验。该实验的操作过程和实验现象是
。
(3)如果玻璃管内装与某红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ;如果玻璃管内装有无色溶液,加热时溶液变红,冷却后恢复无色,此溶液可能是 。
23.(6分)A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B。按如图所示装置仪器,挤压滴管的胶头时,可以得蓝色喷泉;A与浓H2SO4反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
 (1)A的化学式是
。
(1)A的化学式是
。
(2)可用于除去B中的水分的干燥剂是
,
实验制取气体B的化学方程式是
。
(3)收集气体B的方法是
。
收集气体C的方法是 。
22. (7分)在密闭容器中的可逆反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应放热),达到平衡后:
(7分)在密闭容器中的可逆反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应放热),达到平衡后:
(1)扩大容器体积,体系压强 ,反应混合物颜色 ,平衡 。
(2)升高温度,平衡 ,混合气体分子数目 。
(3)加入催化剂,NO的物质的量 ,原因是
。
21.(6分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色,回答下列问题。
 (1)下列物质的化学式为:
(1)下列物质的化学式为:
B:
C:
E:
(2)下列反应的化学方程式:
A→D:
A→C:
B→E:
20.在容积相等的两密闭容器A和B中,保持温度423K,同时向A、B中分别加入a mol及b mol碘化氢(a>b),待反应2HI(g)⇌H2(g)+I2(g)达平衡后,下列说法肯定正确的是
A.化学反应速率vA<vB B.平衡时A和B体系颜色相同
C.平衡时碘蒸气在混合气体中的质量分数,A容器大于B容器
D.平衡时HI的分解率相同
姓名: 学号: 总分:
|
第Ⅱ卷(共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com