
题目列表(包括答案和解析)
24、银锌(Ag-Zn)可充电电池广泛用做各种电子仪器的电源,电解
 质为KOH。其电池总反应为Ag2O
+ Zn + H2O 2Ag + Zn(OH)2 ,则
质为KOH。其电池总反应为Ag2O
+ Zn + H2O 2Ag + Zn(OH)2 ,则
下列说法正确的是( )
A、放电时Ag2O参与反应的电极为负极
B、放电时正极附近的pH逐渐增大
C、充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH-
D、充电时每生成1 mol Ag2O转移1 mol电子
23、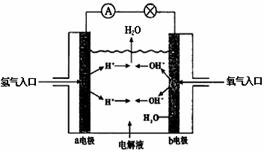 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
A、a电极是负极
B、b电极的电极反应为:
4OH--4 e-=2H2O +O2
C、电池工作时,电子由正极通过
外电路流向负极
D、氢氧燃料电池是一种具有应用前景的绿色电源
22、物质的量浓度相同的下列溶液中,符合PH由小到大顺序排列的是( )
A、Na2CO3 NaHCO3 NaCl NH4Cl
B、NaHCO3 Na2CO3 NH4Cl NaCl
C、NH4Cl (NH4)2SO4 Na2S NaNO3
D、(NH4)2SO4 NH4Cl NaNO3 Na2S
21、用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24 L气体(标准状况)。下列有关说法正确的是( )
A、阴极生成的铜为5.6g
B、上述电解过程中共转移0.2 mol电子
C、电解得到的Cu的物质的量为0.5mol
D、电解后溶液呈碱性
20、在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的
是( )
A、 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- B、 pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- C、 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ D、 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+
19、 下列离子方程式正确的是( )
A、 碳酸的电离
H2CO3 H+
+ HCO3-
下列离子方程式正确的是( )
A、 碳酸的电离
H2CO3 H+
+ HCO3-
B、 将金属钠加入水中 Na + 2H2O = Na+ + 2OH- + H2↑
C、 硫化钠水解 S2- + 2H2O = H2S↑ + 2OH-
D、向氯化铝溶液中加入过量的烧碱溶液 Al3+ + 3OH-= Al( OH )3↓
18、表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的( )
A、C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-)
B、C(Na+) = C(HCO3-)
C、C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-)
D、C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3)
17、把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
A、(CH3COO-)>C(Na+) B、C(CH3COOH)+C(CH3COO-)=0.01mol/L
C、C(CH3COOH)>C(CH3COO-) D、无法判断
16、下列各组溶液充分混合后,混合液的PH一定大于7的是( )
A、PH=3的醋酸与PH=11的NaOH等体积混合
B、PH=2的盐酸与PH=12的Ba(OH)2等体积混合
C、0.1mol·L-1的酸性溶液与0.2mol·L-1的碱性溶液等体积混合
D.PH = 9的溶液稀释至1000倍
14、不能用于判断HA是弱电解质(弱酸)的依据是( )
A、浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
B、PH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。
C、浓度相等的HCl与HA两溶液,C(HCl中H+)约是C(HA中H+)的100倍。
D、PH相等的HCl与HA两溶液,C(HA)约是C(HCl)的100倍。
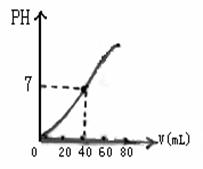 15、用1.0 mol·L-1 NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如右图所示,则原H2SO4
15、用1.0 mol·L-1 NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如右图所示,则原H2SO4
溶液的物质的量浓度和完全反应后溶液
的大致体积是( )
A、1.0mol·L-1、 60mL
B、0.5mol·L-1、 80mL
C、0.5mol·L-1、 40mL
D、1.0mol·L-1、 80mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com