
题目列表(包括答案和解析)
4.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述正确的是
A.NH4H是共价化合物 B.NH4H溶于水,所形成的溶液显碱性
C.NH4H与水反应时,水被氧化 D.NH4H中的H元素均为+1价
3.下列离子方程式正确的是
A. 苏打溶液中滴入少量稀盐酸: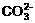 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
B. 漂白粉溶液中通入过量CO2:Ca2++ 2ClO-+CO2+H2O=2HClO+ CaCO3↓
C. 三氯化铁溶液中滴入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3
D. 稀硝酸中加入少量铁粉:3Fe+ 4H++2NO3-= 3Fe2++2NO↑+ 2H2O
1.下列试剂的保存方法,错误的是:
A.把浓硝酸放在棕色瓶中,并置于冷暗处保存
B.把AgNO3放在棕色瓶中保存
C.把红磷放在广口瓶中密闭保存,把白磷保存在煤油中保存
D.把NaOH溶液放在带橡皮塞的玻璃瓶中保存
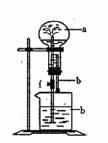 2.在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
2.在下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:
|
|
a(干燥气体) |
B(液体) |
|
A |
NO2 |
水 |
|
B |
CO2 |
饱和NaHCO3溶液 |
|
C |
Cl2 |
饱和NaCl溶液 |
|
D |
NH3 |
1mol·L-1盐酸 |
23.(7分)用石墨作电极电解500mLCuSO4溶液,可以观察到A电极表面有红色固体物质生成,当溶液中的原有溶质完全电解后,停止电解;取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
(1)B电极发生反应的电极反应式为 。
(2)若电解前后溶液的体积不变,请计算电解后溶液的pH。
21. (8分)现有反应:CO(g) + H2O(g) CO2(g)
+ H2(g) △H < 0,在850℃时,平衡常数K = 1。
(8分)现有反应:CO(g) + H2O(g) CO2(g)
+ H2(g) △H < 0,在850℃时,平衡常数K = 1。
(1)该反应的平衡常数表达式为K = ,若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,则:
①当x = 5.0时,上述反应向 (填“正反应”或“逆反应”)方向进行;
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ;
(3)能判断该反应达到平衡状态的依据是 (填代号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2O) = v逆(H2) D.c(CO2) = c(CO)
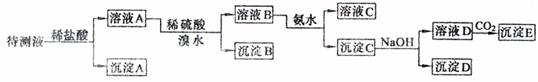 22.(8分)某待测液中,可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、NH4+、Ba2+等离子。进行下述实验(所加试剂均是过量的)。
22.(8分)某待测液中,可能含有Fe2+、Fe3+、Ag+、Al3+、Ca2+、NH4+、Ba2+等离子。进行下述实验(所加试剂均是过量的)。
(1)判断待测液中有无Ba2+、Ca2+, ,
理由是 ;
(2)沉淀D的化学式为 ;
(3)写出由溶液D生成沉淀E的离子方程式 。
20.(15分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液的方法是
;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+ +
Cl-
AgCl(S) Ag+ +
Cl-
在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1,③中银离子的浓度为 mol·L-1。
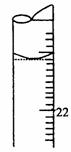 18.(9分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
18.(9分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴
酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使
之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”至“0”刻度以下,记下读数
|
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号)
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL.
 19.(7分)下图为氨氧化法制硝酸的实验装置示意图
19.(7分)下图为氨氧化法制硝酸的实验装置示意图
A.氨水(浓氨水:水= 1.5:1) B.催化剂(Cr2O3)
C.干燥剂(无水氯化钙) D.氧化瓶
E.吸收瓶(水、石蕊溶液) F.NaOH溶液
请回答下列问题:
(1)装置B中发生反应的化学方程式为 ;
(2)该实验的装置B中使用Cr2O3作催化剂,而工业生产中实际使用的催化剂主要是
;
(3)装置E中反应时,氧化剂与还原剂的质量比为 ;
(4)F中用NaOH溶液吸收氮的氧化物,NO2被NaOH溶液吸收生成硝酸盐和亚硝酸盐的水溶液,其离子方程式为 。
17.对于某些离子检验的方法、现象及结论,一定正确的是 ( )
A.加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊;一定含有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失;一定含有SO42-
C.加入氢化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝色;一定含有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加稀盐酸沉淀消失;一定含有Ba2+
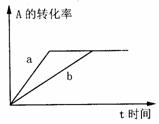
16. 可逆反应:A (g) + 2B(g) 3C(g) + D(s)(正反应的
可逆反应:A (g) + 2B(g) 3C(g) + D(s)(正反应的
△H > 0)在密闭容器中进行,右图中的曲线a代表一
定条件下该反应的过程,欲使a曲线变为b曲线,可以
采取的措施是 ( )
A.增大A的浓度 B.使用催化剂
C.升高温度 D.增大容器的容积
15.用标准氢氧化钠溶液中和醋酸溶液时,若反应后溶液的pH等于7,则此时 ( )
A.醋酸和氢氧化钠的物质的量相等 B.醋酸和氢氧化钠恰好中和
 C.氢氧化钠过量 D.醋酸有剩余
C.氢氧化钠过量 D.醋酸有剩余
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com