
题目列表(包括答案和解析)
9.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L醋酸 D.0.5mol/L氯化钾
8.现有H+ 浓度相同的醋酸溶液和盐酸,分别用蒸溜水稀释至原体积的m倍和n倍,稀释后两溶液的H+ 浓度仍然相等,则m和n的关系是
A.m > n B.m = n C.m< n D.无法确定
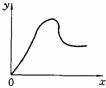
7.向冰醋酸中不断加水时的变化曲线如右图,若x表示加水的量,则y轴可表示为( )
A.导电性 B.H+的物质的量
C.C(OH-) D.C(CH3COOH)的电离程度
6. 现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于( )
现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于( )
A a-lg2 B b-lg2 C a+lg2 D b+lg2
5.在二氧化碳溶于水的平衡体系中,存在以下电离:
H2CO3  H++HCO3- HCO3-
H++HCO3- HCO3-  H++CO32-,若使溶液的pH增大,则C(CO32-)将 ( )
H++CO32-,若使溶液的pH增大,则C(CO32-)将 ( )
A.增大 B.减小 C.不变 D.可能增大也可能减小
4.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
3.某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是
A.中性溶液中pD=7
B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12
C.在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2
D.向100mL 0.25mol·L-1的DCl重水溶液中加入50mL 0.2mol·L-1的NaOD的重水溶液,其中pD=2
2.水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是( )
A 1×10-4 B 55.6×107 C 1×107 D 6.02×1021
1.下列电离方程式正确的是
A.醋酸溶于水:CH3COOH =CH3COO- + H+
B.熔融状态下的NaHSO4:NaHSO4 = Na+ + H+ +SO42-
C.碳酸氢钠溶于水:HCO3- +H2O  CO32- + H3O+
CO32- + H3O+
D.硫化氢溶于水:H2S  2H+ + S2-
2H+ + S2-
10.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq) + H2(g) △H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H2




|
下列说法正确的是
A.△H1 >△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
11.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.化学反应能否自发进行,与反应焓变和熵变有关。当△H-T△S <0时,反应非自发,
非自发反应在任何条件下都不能实现
12.下列说法不正确的是
A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数 D.催化剂能增大单位体积内活化分子的百分数,从而增大反应速率
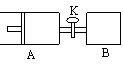 13.如右图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+ Y(g)
13.如右图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+ Y(g) 2Z(g)
+ W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
2Z(g)
+ W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
A.反应速率:v(B)> v(A) B.A容器中X的转化率为80%
C.平衡时的压强:PB = 2PA D.平衡时Y的体积分数:A<B
14.醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右下图所示,有关说法正确的是
 A.a、b、c三点溶液的pH:a>b>c
A.a、b、c三点溶液的pH:a>b>c
B.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.若在“O”点醋酸双聚成八元环分子,则其结构为:
15.在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气) 2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
A.2molA和lmolB B.1 molA和lmolB
C.1molA和2molB D.1molB和1 molC
16.下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是: A.FeCl2 、 FeCl3 B.Na2CO3 、NaHCO3
C.NaAlO2 、AlCl3 D.Mg(HCO3)2、MgCl2
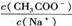 17.欲使CH3COONa稀溶液中的值增大,可采取的措施是
17.欲使CH3COONa稀溶液中的值增大,可采取的措施是
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体Na2CO3
18.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中
c(NH4+):①>②>③
D.相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的
c(H+):①>②>③
19.一定温度下,将amolPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5(g)
PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入amolPCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是
A.2 p1> p2 B.PCl5的分解率增大 C.2 p1< p2 D.PCl3%(体积含量)增大
20.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是:
A.混合溶液中由水电离出的c(OH¯)<0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D.c(OH¯)+c(HX) = c(H+) = 1×10-8mol·L-1
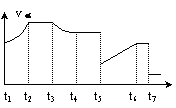 21.右图为可逆反应:A(s)+D(g)
21.右图为可逆反应:A(s)+D(g)
 E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是
E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是
A.t3时刻可能采取的措施是减小c(D)
B.t5时刻可能采取的措施是降温
C.t7时刻可能采取的措施是减小压强
D.t5~t6时间段平衡向逆反应方向移动
第Ⅱ卷(共45分)
22.(9分) 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值
会 (均填“偏大”、“偏小”、“无影响”)。
23.(4分)1836年俄国化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关。按此规律,结合下述反应方程式,填空。
已知:
(1)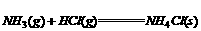 ;△H=-176kJ/mol
;△H=-176kJ/mol
(2)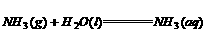 ;△H=-35.1kJ/mol
;△H=-35.1kJ/mol
(3)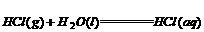 ;△H=-72.3kJ/mol
;△H=-72.3kJ/mol
(4)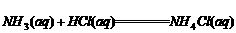 ;△H=-52.3kJ/mol
;△H=-52.3kJ/mol
则(5)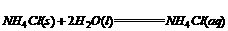 ;△H=_____________。
;△H=_____________。

24.(12分)某二元酸H2A的电离方程式是:H2A=H++HA-, HA- A2-+H+。回答下列问题:
(1)Na2A溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(2)NaHA溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)若0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可
能 0.11mol·L-1(填“<”、“>”或“=”),理由
(4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的顺序是 ;
(5)pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为 。
25.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二
所示的实验。
 ⑴图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
。
⑴图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
。
图
图一 图二
⑵检查图二装置气密性的方法是 。
图二所示实验中需测量的数据是 。
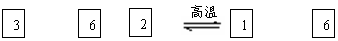 26.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
26.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)该反应的平衡常数表达式为K= ;
(2)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(3)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”) ;
(4)若已知CO生成速率为v(CO)=18mol/(L.min), 则N2消耗速速率为
v(N2)= mol/(L.min)。
1.D 2.D 3.A 4.B 5.C 6.B 7.C 8.D 9.C 10.D 11.C 12.B
13.C 14.D 15.B 16.C 17.C 18.A 19.A 20.C 21.D
22.(8分,每空1分)
(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失。 (3)偏小
(4)不相等; 相等; 因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)偏小; 偏小
23.(4分)+ 16.3kJ/mol(未写“+”和“kJ/mol”各扣1分)
24.(13分,除注明外,每空2分)
(1)碱性(1分)A2- +H2O 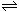 HA-+OH-
HA-+OH-
(2)酸性(1分)HA-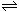 A2+H+
A2+H+
(3)<(1分), H2A电离产生的H+抑制了HA-的电离
(4)C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-)
(5)5×10-12mol/L.(未写单位扣1分)
25.(共10分,每空2分)
⑴反应产生气泡快慢或反应完成的先后(或试管壁的冷热程度)
控制阴离子相同,排除阴离子的干扰
将FeCl3改为Fe2(SO4)3
⑵关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 (或其他合理答案)
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
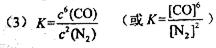 26.(共10分,每空2分)
26.(共10分,每空2分)
. 11
(2)小于(2分);减小(2分)
(3)逆(2分) (4)6(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com