
题目列表(包括答案和解析)
13. 反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
12.强酸和强碱稀溶液的中和热可以表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①.HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=a kJ·mol-1
②.1/2H2SO4(浓)+KOH(aq)=1/2K2SO4(aq)+H2O(l);△H=c kJ·mol-1
③.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=b kJ·mol-1
则a、b、c三者的大小关系为( )
A.a>b>c B.c>b>a C.a=b=c D.a >c> b
11. 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是( )
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
10.加热装有1
molHI气体的定容密闭容器,在t1 ℃,2HI(g) H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是 ( )
H2(g)+I2(g);△H<0反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2
molHI,在t2 ℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是 ( )
A.若t1=t2,则x1=x2 B.若t1=t2,则x1<x2 C.若t1<t2,则x2< x1 D.若t1<t2,则x1=x2
9.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是( )
A CH3OH的燃烧热为192.9kJ·mol-1
B 反应①中的能量变化如右图所示
C CH3OH转变成H2的过程一定要吸收能量
D 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
8.已知热化学反应方程式:
Zn(s)+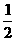 O2(g)
O2(g) ZnO(s);ΔH= -351.5
kJ·mol-1
ZnO(s);ΔH= -351.5
kJ·mol-1
Hg(l)+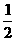 O2(g)
O2(g)  HgO(s);ΔH= -90.84
kJ·mol-1
HgO(s);ΔH= -90.84
kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
 ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A. ΔH= +260.7 kJ·mol-1 B. ΔH= -260.7 kJ·mol-1
C. ΔH= -444.2 kJ·mol-1 D. ΔH= +444.2 kJ·mol-1
7.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H =-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H =-2869kJ/mol
下列说法正确的是( )
A、正丁烷分子储存的能量大于异丁烷分子 B、正丁烷的稳定性大于异丁烷
C、异丁烷转化为正丁烷的过程是一个放热过程 D、 异丁烷分子中的碳氢键比正丁烷的多
6.已知热化学方程:
2KNO3(s) = 2KNO2(s) +O2(g);△H = +58kJ/mol
C(s) +O2(g) = CO2(g);△H =-94kJ/mol
为提供分解1molKNO3所需的能量,理论上需完全燃烧碳( )
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
5.在一个绝热的体积一定的密闭容器中发生可逆反应:
N2(g) + 3H2(g)  2NH3(g)
; △H<0
2NH3(g)
; △H<0
下列各项中不能说明该反应已经达到平衡状态的是 ( ) A.体系的压强不再改变 B.体系的温度不再改变 C.断裂1mol N≡N键的同时,也断裂6molN-H键 D.反应消耗的 、与产生的的速率υ() : υ() : υ() == 1∶3 ∶2
4. 在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g) 
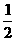 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com