
题目列表(包括答案和解析)
23.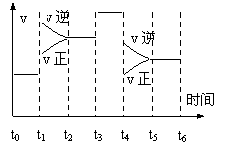 一密闭容器中发生下列反应:
一密闭容器中发生下列反应:
N2(g)+3H2(g)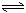 2NH3(g);ΔH<0
2NH3(g);ΔH<0
下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1). t1、t3、t4时刻,体系中分别是什么条件发生了
变化?
______________________ 、______________________、 ____________________.
(2).下列时间段中,氨的百分含量最高的是_________.
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
22.在密闭容器中,通入amolN2和bmolH2,在一定条件下达到平衡,容器中还剩余cmolN2.
(1).生成NH3的物质的量为 .
(2).平衡时H2的转化率为 .
(3).若把容器体积减小一半,则正反应速率 ,逆反应速率 ,N2转化率 .(填“变大”、“变小”、或“不变”)
21. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量. 已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1.由N2和H2合成1molNH3时可放出46.2kJ的热量. N-H键的键能是______________.
20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
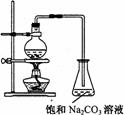 (1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(2)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为: 、 等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
选择性(%)* |
反应时间/h |
转化率(%) |
选择性(%)* |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
*选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A 120℃,4h B 80℃,2h C 60℃,4h D 40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为 。
19. “碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t
/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
18..一定温度下可逆反应:A(s)+2B(g)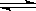 2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
A 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t3前的反应速率变化已省略)

图1 图2 图3
17.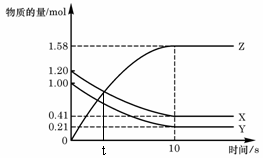 一定温度下,在2 L的密闭容器中,X、Y、Z
一定温度下,在2 L的密闭容器中,X、Y、Z
三种气体的物质的量随时间变化的曲线如右图,
下列描述正确的是( )
A.t秒时该反应达到化学平衡状态
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g) 2Z(g)
2Z(g)
16.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g)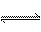 2C(g);△H<0
2C(g);△H<0
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
增大体积 |
A的转化率 |
|
D |
降低温度 |
混合气体的密度 |
15.工业上生产苯乙烯是利用乙苯在560度时的脱氢反应:
C8H10 (g) 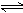 C8H8(g)
+ H2(g)
C8H8(g)
+ H2(g)
针对上述反应,有人提出如下观点,其中合理的是( )
A.在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率
C.在乙苯反应达到平衡过程中,体系的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件
14.
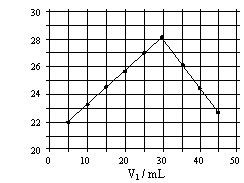 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com