
题目列表(包括答案和解析)
2、葡萄糖作为营养剂供给人体能量,在体内发生主要的反应是( )
A、氧化反应 B、取代反应
C、加成反应 D、聚合反应
1、葡萄糖是一种单糖的主要原因是( )
A、糖类中含碳原子数最少 B、不能再水解成更简单的糖
C、分子中只有一个醛基 D、糖类中结构最简单
30.有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出24mL用0.025mol/LH2SO4
滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的pH(设体积可以加和)。
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
29.常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为多少?
28.用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合
液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测
定NaOH的含量? 。
(2)滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则能否由此准确
地计算出结果? 。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
27. 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
① ,② ,③ ,④ ,⑤ 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,未洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读数(滴定管)开始时仰视,终点时俯视
26.如图所示,若电解5min时铜电极质量增加2.16g,
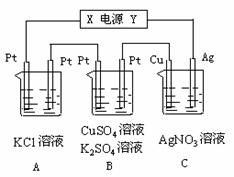 试回答:
试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________,B池_______,
C池________。
⑶ 通过5min时,B中共收集224mL气体(标
况),溶液体积为200mL,则通电前硫酸铜溶
液的物质的量浓度为______________。
⑷ 若A中KCl溶液的体积也是200mL,电解
后溶液的pH = ______。
25.某二元酸H2A的电离方程式是:H2A=H++HA-,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)Na2A溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(2)NaHA溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)若0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能 0.11mol·L-1(填“<”、“>”或“=”),理由是: ;
(4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的顺序是 。
24. 如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起
如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起
始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下
列反应:2X(g)+2Y(g) 3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
3Z(g)+2W(g)(正反应是放热反应),达到平衡(Ⅰ)
时,V(B)=1.2aL。请回答:
(1)B中X的转化率α(X)B为 ;
(2)打开K,过一段时间重新达到平衡(Ⅱ)时,B的体
积为 (用的代数式表示,连接管中气体体积不
计)。
23. A是由导热材料制成的密闭容器,B是一耐化学腐
A是由导热材料制成的密闭容器,B是一耐化学腐
蚀且易于传热的气球.关闭K2,将等量且少量的
NO2通过K1、K3分别充入A、B中,反应开始时,A、
B的体积相同。已知:
2NO2(g) N2O4(g) △H<0。
N2O4(g) △H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不 变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 ;
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将 。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com