
题目列表(包括答案和解析)
7、一定温度下,某密闭容器中的反应为:aX(g)+bY(g) cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则
cZ(g)+dW(g),经5min达到平衡,X减少n
mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则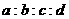 为:
为:
A.3:1:2:1 B.1:3:2:2 C.1:3:1:2 D.3:1:2:2
6、在密闭容器中进行下列反应2A+3B 2C,开始时,C的浓度为a mol·L-1
,2 min时,C的浓度变为2a mol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中错误的是:
2C,开始时,C的浓度为a mol·L-1
,2 min时,C的浓度变为2a mol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中错误的是:
A.用B表示的反应速率是0.75a mol·(L·min)-1
B.反应开始时,c(B)=3a mol·L-1
C.反应2 min时,c(A) = 0.5a mol·L-1
D.反应2min时,A的转化率为50%
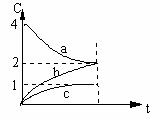
5、800℃时,a、b、c三种气态物质的浓度随时间变化的情况如右图,由图分析不能得出的结论是:
A.a是反应物
B.正反应是一个体积扩大的反应
C.若升高温度,a的转化率增大
D.若增大压强,a的转化率减小
4、反应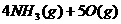

 在10L密闭器中进行,半分钟后,水蒸气的量增加了0.45mol,则此反应的平均速率
在10L密闭器中进行,半分钟后,水蒸气的量增加了0.45mol,则此反应的平均速率 可表示为:
可表示为:
A.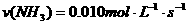 B.
B.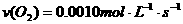
 C.
C.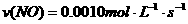 D.
D.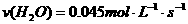
3、对于反应M+N P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为:
P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为:
A.2 min B.3 min C.6 min D.9 min
2、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是:
A.对该反应体系加热 B.不用稀硫酸,改用98%浓硫酸
C.加入少量NaHSO4固体 D.不用铁片,改用铁粉
1、本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
28.某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。该化合物分子中含有 个氧原子。
27.有机物甲的分子式为C4H6O5,将甲与足量的CH3CH2OH混合与浓硫酸共热,生成相对分子质量为190的有机物乙,由此可知:甲中含 个羧基。
26.(11分)已知一个碳原子上连有两个羟基时,易发生下列转化: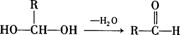
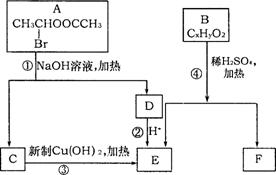 请根据右图回答:
请根据右图回答:
(1)E中含有的官能团的名称是 ;反应①和③的化学方程式为 ,
(2)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为 。
(3)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中两种苯环上取代基个数不同的同分异构体的结构简式 、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com