
题目列表(包括答案和解析)
11.下列事实中,不能用勒沙特列原理来解释的是:
A.在配制FeCl3溶液时,是先用稀盐酸溶解,再加水稀释至所需的浓度
B.使氢硫酸中加碱有利于S2-离子增多
C.500℃左右比室温更有利于合成氨反应
D.高压条件有利于合成氨反应
10.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是:
A.加入一种反应物
B.对平衡体系加压
C.升高温度
D.使用催化剂
9.下列除去杂质的操作方法正确的是:
A.NO2中有少量的NO:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的O2:通过灼热的铜网
D.红磷中有少量的白磷:加热到40℃,使白磷自燃
8.在密闭容器中可逆反应aA(气)+bB(气)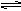 cC(气)+dD(气)+Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是:
cC(气)+dD(气)+Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是:
A.a+b<c+d, Q<0 B.a+b>c+d, Q<0
C.a+b<c+d, Q>0 D.a+b=c+d, Q<0
7.在可变容积的密闭容器中通入体积比为2:3的气体A和气体B,在一定条件下发生如下反应:A+3B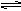 2C (A.B.C均为气体)当反应达化学平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是:
2C (A.B.C均为气体)当反应达化学平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是:
A.5:6 B.5:4 C.5:3 D.5:2
6.8g氮的氧化物NxOy 和50g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol Fe3O4和0.1mol N2,则NxOy是:
A. NO B. N2O3 C. NO2 D.N2O5
5.一定条件下反应mA(g)+ nB(g) pC(g)+
qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是:
pC(g)+
qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是:
A.3、1、2、1 B.3、1、2、2 C.2、6、3、5 D.1、3、2、2
4.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
3.下列说法正确的是:
A.相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,[OH-]之比是2:1
B.在NH3+NaH=NaNH2+H2↑的反应中,NH3为还原剂
C.0.1 mol·L-1 NH4Cl溶液中的[NH4+]=[Cl-]
D.0.2 mol·L-1氨水溶液中,[NH4+]+[NH3]+ [NH3•H2O]= 0.2 mol·L-1
2.下列关于浓HNO3与浓H2SO4的叙述正确的是:
A、露置于空气中,溶液浓度不变 B、常温下都能与铜较快反应
C、露置于空气中,溶液质量均减轻 D、常温下都可用铁制容器贮存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com