
题目列表(包括答案和解析)
4.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)=5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
3.已知:H2(g)+I2(g)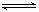 2HI(g)的平衡常数为K1;
2HI(g)的平衡常数为K1;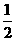 H2(g)+
H2(g)+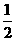 I2(g)
I2(g)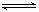 HI(g)的平衡常数为K2,则K1、K2的关系为
HI(g)的平衡常数为K2,则K1、K2的关系为
A.K1=2K2 B.K1= K22 C.K1 = K2 D.K1= K2
2.已知下列热化学方程式
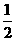 CH4(g)+O2(g)=
CH4(g)+O2(g)=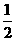 CO2(g)+H2O(l);△H=-445.15kJ·mol-1
CO2(g)+H2O(l);△H=-445.15kJ·mol-1
CH4(g)+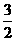 O2(g)=CO(g)+2H2O(l);△H =-607.3
kJ·mol-1
O2(g)=CO(g)+2H2O(l);△H =-607.3
kJ·mol-1
CH4(g)+2O2(g)=CO2 (g)+2H2O(l);△H =-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2 (g)+2H2O(g);△H =-802.3 kJ·mol-1
则甲烷的燃烧热为
A.445.15kJ·mol-1 B.607.3 kJ·mol-1 C.890.3 kJ·movl-1 D.802.3 kJ·mol-1
1.在450C密闭容器中进行下列反应:2SO2(g)+O2(g)  2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是
2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是
A.v(O2)=1.5×10-3 mol·L-1·s-1 B.v(O2)=1.5×10-4mol·L-1·s-1
C.v(SO2)=3.0×10-3 mol·L-1·s-1 D.v(SO3)=3.0×10-5 mol·L-1·s-1
33、有一元羧酸和一元醇形成的酯A。燃烧0.1molA,可得到5.4gH2O和6.72LCO2(标准状况)。3.7g A与100mL某浓度NaOH溶液共热,当完全水解后,为中和剩余的NaOH,需消耗0.5
mol·L-1盐酸60mL。求:
⑴A的分子式。
⑵A在酸性条件下水解后的两种产物的相对分子质量相等,写出A的结构简式。
⑶NaOH溶液的物质的量浓度。
32、某一醋酸溶液的PH与硫酸溶液相同。20mL硫酸溶液恰好能被0.01 mol·L-12mL的NaOH溶液中和;取20mL该醋酸溶液用0.1 mol·L-1的NaOH溶液滴定,消耗NaOH溶液20mL。求:⑴硫酸溶液的物质的量浓度;⑵醋酸溶液中CH3COOH与 CH3COO-的个数之比。
31、某兴趣小组设计如下过程,分离乙醇、苯酚和乙酸的混和溶液。回答下列问题:
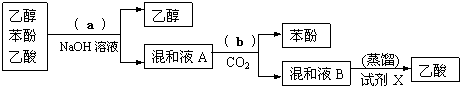
⑴写出分离过程中的操作方法:a ▲ ,b ▲ ;
⑵试剂X为 ▲ ;
⑶写出混和液A中通入CO2发生反应的离子方程式: ▲
30、用已知浓度的盐酸滴定未知浓度的NaOH溶液,以酚酞作指示剂。
⑴滴定终点时溶液的颜色变化为 ▲ ;
⑵为减少滴定误差,在选择盐酸的物质的量浓度和酸式滴定管的规格时,下列四个选项中最佳的是 ▲ (填写字母A、B、C…,下同);
A、1.00mol·L-1,50mL B、0.20mol·L-1,25mL
C、0.05mol·L-1,15mL D、5.00mol·L-1,10mL
⑶下列操作将会导致测量值一定大于真实值的有 ▲ 。
A、未用标准液润洗酸式滴定管 B、用待测液润洗锥形瓶
C、开始滴定时,酸式滴定管中盐酸的液面略低于“0”刻度
D、滴定终点时俯视滴定管的液面读数
E、滴定前酸式滴定管中有气泡,滴定后酸式滴定管中无气泡
29、已知在同一碳原子上连有两个羟其的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。

⑴条件2为 ▲ 。
⑵写出苯甲醛与新制Cu(OH)2浊液反应的化学方程式 ▲ 。
⑶苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B反应可生成一种新的化合物C的化学方程式 ▲ 。
28、⑴浓度均为0.1 mol·L-1的NaOH溶液和氨水各50 mL,在测定导电性实验中,灯泡发光较暗的是 ▲ ,其原因是(用电离方程式表示) ▲ 。
⑵在上述两种溶液中均滴加0.1 mol·L-1的盐酸进行中和,在滴加过程中,氨水导电性实验中灯泡发光程度的变化是 ▲ 。
⑶当氨水恰好完全反应时,所得溶液中离子浓度由大到小的顺序为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com