
题目列表(包括答案和解析)
21、(14分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:

(1)写出烧瓶B中发生反应制氨气的化学方程式:
用平衡移动原理解释能用此法制取氨气的原因:
。
(2) 本实验进行一段时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色
硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现
象,写出在硬质玻璃试管内发生反应的化学方程式:
_______________ __________ __,这个反应说明氨气具有______________
(填编号:A、碱性 ;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶D中盛浓硫酸的主要作用是 ________ _________。
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置F的作用是____ _______________。
20、(3分)工业上拟用铜和硝酸来制备Cu(NO3)2·3H2O,下面是三个同学提出的生产方案:
甲方案:铜+浓HNO3-→蒸发结晶
乙方案:铜+稀HNO3-→蒸发结晶
丙方案:铜 氧化铜
氧化铜 蒸发结晶
蒸发结晶
你认为________方案最好,理由是___________________________________________。
19.(11分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下
都是气体,B为红棕色,回答下列问题。
(1)下列物质的化学式为:
B: C: E:
(2)下列反应的化学方程式:
A→D:
A→C:
B→E:
D→C:
17 (共15分)
A、(8分)用双线桥表示下列反应中得失电子的情况,该反应的氧化剂 、
氧化产物 、该反应中被还原的HNO3与未被还原的HNO3的质量
之比为 。
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
B、(3分)配平:
SO32- + MnO4- + H+ - Mn2+ + SO42- + H2O
C、(4分)在一定条件下,可逆反应:mA+nB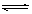 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的
关系是 ;
(2)A、C是气体,增加B的量,平衡不移动,则B为 态;
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的
方向是 ;
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
18.(6分)在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生
如下反应:X(g)+Y(g)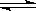 2Z (g)。(正反应是放热反应)
2Z (g)。(正反应是放热反应)
(1)反应达到平衡后,若降低温度,化学反应速率 ,Z的浓度 。
(填“增大”、“减小”或“不变”)。
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
|
|
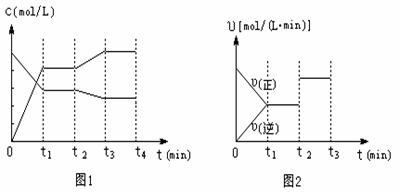
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
。(用文字表达)。
由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
16.M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中
M的化合价是 ( )
A.+1 B.+3 C.+4 D.+6
高二年级化学试卷成绩统计表(考生不要填写)
第I卷答题栏(选择题,共48分)
第Ⅱ卷(非选择题 共60分)
15.一定温度下,在一个容积固定不变的密闭容器中进行X(g)+3Y(g)  4Z(g)+W(s)反应,达
4Z(g)+W(s)反应,达
到平衡状态的标志是 ( )
①气体的密度不再变化 ②单位时间内生成amolX,同时生成3amolY
③气体的压强不再变化 ④单位时间内生成3amolY,同时生成4amolZ
A.②④ B.②③ C.①④ D.①②
14.一定温度时于密封容器中发生反应:mA(g)+nB(g)  pC(g),达平衡后,若将气体体积
pC(g),达平衡后,若将气体体积
压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍。若压缩过程中温度保持不变,则下
列叙述正确的是( )
A.平衡向正反应方向移动
B.C气体的质量分数增大
C.气体A的转化率降低
D.m+n>p
13.在一定温度和压强下,将装有NH3和NO2混合气体的试管倒立在水中,经足够时间后,
试管内气体的体积缩小为原体积的1/6,则原混合气体中NH3与NO2的体积比是( )
A.1:1 B.3:2
C.1:3 D.5:1
12.下列各组离子可以大量共存的是( )。
(A) H+、K+、Fe2+、NO3–
(B) OH–、Na+、Cl–、NH4+
(C) Mg2+、Cl–、K+、NO3–
(D) Ag+、NO3–、Na+、S2–
)
11.合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是
①减压 ②加压
③升温 ④降温
⑤及时从平衡混合物中分离出NH3
⑥充入N2或H2
⑦加催化剂 ⑧减小N2或H2的量
A. ①③④⑤⑦ B. ②⑥
C.②⑤⑥ D. ②③⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com