
题目列表(包括答案和解析)
8、下列分子中,结构构成平面三角形的是( )
A、HgCl2 B、H2O C、CCl4 D、SF6
7.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解 B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
6.下列事实中能证明氯化氢是共价化合物的是 ( )
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
5.下列物质中,难溶于CCl4的是 ( )
A.碘单质 B. 水 C. 苯 D.甲烷
4.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
3.有关乙炔分子中的化学键描述不正确的是 ( )
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
1.石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合。
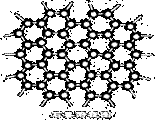 下图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为
( )
A.1:3
B.2:3
下图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为
( )
A.1:3
B.2:3
C.2:1 D.3:2 2。S轨道与p轨道杂化的类型不可能有 ( )
A、sp B、sp2 C、sp3 D、sp4
36.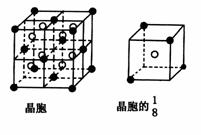 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,其原因是
(2) B的离子结构示意图为 ,元素C在元素周期表中的位置是 ;
(3) A和E形成的化合物的电子式是 ,它的晶体类型为 晶体。
(4)C原子的电子排布式是 。
35. 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。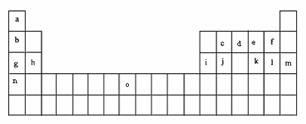
试回答下列问题
(1)元素“O”在周期表中的位置是 。
 (2)画出“c”的简化电子排布式
。
(2)画出“c”的简化电子排布式
。
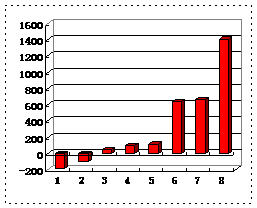
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母,下同),“7”代表 。
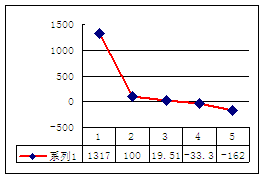
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为:
;序列“1”氢化物的电子式为: 。
34.下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
|
最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。
某元素R的原子半径为1.02×10-10m,该元素最高价氧化物的水化物化学式为 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你尝试写出该化合物的电子式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com