
题目列表(包括答案和解析)
13、人体血液的正常pH约为7.35-7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
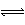
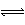 H++HCO3+ H2CO3 CO2+H2O
H++HCO3+ H2CO3 CO2+H2O
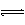
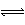 H++PO43- HPO42- H++HPO42- H2PO4-
H++PO43- HPO42- H++HPO42- H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是:
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小。
12、下列叙述正确的是
A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合:
c(Na+)+c(H+) = 2c(CO32-)+c(OH-)
B.某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-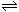 H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
C.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.常温下,10 mL pH=12的Ba(OH)2溶液与40 mLcmol·L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50 mL,则溶液pH=11
11、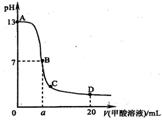 在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如下图
所示,有关粒子浓度大小关系正确的是
A.在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+)
B.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
C.在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+)
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
10、某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)= c(Na+),则溶液一定呈中性
B.溶液中不可能存在c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在
c(Na’)> c(OH-)> c(A-)> c(H+)
D.若溶质为NaA、HA,则一定存在c(A-)> c(Na+)> c(H+)> c(OH-)
9、将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若V1>V2,则将两种酸溶液稀释相同倍数,HA溶液的pH大于HB溶液的pH
8、今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a+b=0.2mol/L
7、已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO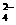 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃ B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
6、已知某温度下,在100 mL浓度为0.01 mol/L的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是
A.溶液的pH=2 B.c(Na+)=0.01 mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
5、将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)> c(A-)> c(H+)> c(OH-)
4、25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=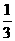 y,则x值为
y,则x值为
A.2 B.3 C.4 D.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com