
题目列表(包括答案和解析)
1、关于原子结构模型的演变过程,正确的是( )
A、汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B、汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C、道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→汤姆逊原子模型→量子力学模型
D、道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
34、(9分)有一元羧酸和一元醇形成的酯A。燃烧0.1molA,可得到5.4gH2O和6.72LCO2(标准状况)。3.7g A与100mL某浓度NaOH溶液共热,当完全水解后,为中和剩余的NaOH,需消耗0.5 mol·L-1盐酸60mL。求:
⑴A的分子式。
⑵A在酸性条件下水解后的两种产物的相对分子质量相等,写出A的结构简式。
⑶NaOH溶液的物质的量浓度。
33、(5分)用铜片、锌片和3L稀H2SO4 组成原电池,若铜片上共放出3.36L气体(标准状况)时,H2SO4恰好全部作用完。试计算:⑴产生这些气体所消耗的锌的质量。⑵稀硫酸溶液的PH值?
32、(10分)I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法如加入银氨溶液替代“闻生成物的气味”来检验,写出该化学方法的化学反应方程式 。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单易操作的实验,探究哪一种猜想正确? (写出使用的试剂、现象,结论的要点)
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约l min后鼓入空气。请填写下列空白:(3)乙醇发生催化氧化的化学反应方程式为
。
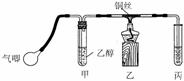 (4)实验时,常常将甲装置浸在70℃-80℃的水浴中,由于装置设计上的缺陷,实验进行时可能会产生
____________不良现象。
(4)实验时,常常将甲装置浸在70℃-80℃的水浴中,由于装置设计上的缺陷,实验进行时可能会产生
____________不良现象。
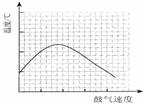 (5)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因: 。
(5)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因: 。
31、(8分)碳正离子[例如CH3+、CH5+、(CH3)3C+]是有机反应的重要中间体。欧拉(G.Olah)因在此领域中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通达CH4在‘超强酸’中再获得一个H+而得到,而CH5+失去H2可以得CH3+
⑴CH3+是反应性很强的正离子,是缺电子的,其电子式是___________________
⑵CH3+中4个原子是共平面的,3个C-H键之间的夹角(键角)相等,则C-H键之间的夹角是___________
⑶(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式为________
⑷(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式为____________________
30、(6分)已知在同一碳原子上连有两个羟其的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。

⑴条件2中试剂为 。
⑵写出苯甲醛与新制Cu(OH)2浊液反应的化学方程式 。
⑶苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式 。
29、(4分)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
28、(4分)在2L的密闭容器中,加入2mol A和1mol B,发生下述反应:2A(g)+B(g) 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
⑴温度不变,若缩小容器的体积,则平衡_______移动(填正向、逆向或不)
⑵维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是________。
A.4molA+2molB B.2molC+1molD
C.2molA+1molB+2molC+1molD D.1molA+0.5molB+1molC+0.2molD
27. 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法正确的是:
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液呈酸性,则一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若溶液呈碱性,则一定满足:c(NH4+)>c(Cl-)
D.若溶液呈中性,则一定满足:c(NH4+)>c(Cl-)
26.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是:
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com