
题目列表(包括答案和解析)
17. 下图
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后发现
为电镀槽。接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通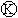 后,使c、d两点短路。下列叙述正确的是
后,使c、d两点短路。下列叙述正确的是
A、a为直流电源的负极
B、c极发生的反应为2H++2e-=H2↑
C、f电极为锌板
D、e极发生氧化反应
16. 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32- + 6H2O,则下列说法错误的是
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32- + 6H2O,则下列说法错误的是
A、放电时CH3OH参与反应的电极为正极
B、充电时电解质溶液的pH逐渐增大
C、放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32- + 6H2O
D、充电时每生成1 mol CH3OH转移6 mol电子
15.将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是(D)

14.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间后(假设电解时温度不变且用惰性电极),下列说法正确的是
A、当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B、电池的正极反应式为:O2 + 2H2O + 4e- = 4OH-
C、电解后c(Na2CO3)不变,且溶液中有晶体析出
D、电池中c(KOH)不变;电解池中溶液pH变大
13.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A、放电时,LiMn2O4发生还原反应
B、放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C、充电时,LiMn2O4发生氧化反应
D、充电时,阳极反应为:Li++e-==Li
12.已知 (1)H2(g)+1/2O2(g)=H2O(g) △H1=a kJ/mol
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ/mol
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ/mol
下列关系式中正确的是
A、a<c<0 B、b>d>0 C、2a=b<0 D、2c=d>0
11.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
A、NaOH B、H2SO4 C、AgNO3 D、Na2SO4
10.下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
9.我国燃煤锅炉采用沸腾炉(注:通过空气流吹沸使煤粉在炉膛内呈“沸腾状”燃烧)的逐渐增多,采用沸腾炉的好处是
A、增大煤燃烧时的燃烧热并形成清洁能源
B、减少煤中杂质气体(如SO2)的形成
C、提高煤炭的热效率,并减少CO的排放
D、使燃料燃烧充分,从而提高燃料的利用率
8.已知:P4(s、白磷)+5O2(g)= P4O10(s) △H =-2983.2 kJ/mol
4P(s、红磷)+5O2(g)= P4O10(s) △H =-2954 kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是
A、吸收29.2kJ热量 B、放出29.2kJ热量
C、放出7.3kJ热量 D、吸收7.3kJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com