
题目列表(包括答案和解析)
2.在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当是
A.a中大 B.b中大 C.a、b中一样大 D.无法判断
[规律总结]对于气体参加的可逆反应,在温度恒定的条件下,涉及体积与压强以及平衡移动有关判断的问题时,可设计一些等效平衡的中间状态来进行求解。这样能降低思维难度,具有变难为易、变抽象为直观的作用。
[例1]在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是( D )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
[例2] 甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下,向甲中通入3mol N2和4mol H2,反应达到平衡时,生成NH3的物质的量为amol。
(1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲平衡中相同。起始时乙中还通入了____mol N2和____mol H2。
(2)相同温度下,若向乙中通入6mol N2和8mol H2,且保持压强与甲相等,当反应达到平衡时,生成氨的物质的量为b mol,则a∶b______1∶2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a∶c_____1∶2 (填“>”、“<”或“=”)。
答案:(1)2mol N2和1mol H2
(2)平衡氨的物质的量物质的量b=2a,所以a∶b=1∶2
平衡时氨的物质的量物质的量c>2a,即a∶c<1∶2。
[例3] 当温度一定时分别往下列容器中充入氢气和氮气,发生如下反应:
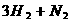

 。A.
。A.  B.
B. 
(1)在恒容容器中
(2)在恒压容器中
充分反应达到平衡时,这两种情形下,氮气的转化率、各物质平衡浓度、平均相对分子质量怎样变化?
答案:(1) 氮气转化率B > A 各物质平衡浓度B > A 平均相对分子质量B > A
(2)氮气转化率B = A 各物质平衡浓度B = A 平均相对分子质量B = A
气体等效平衡练习 命题:岳全国
班 姓名 学号
选择题(每题有1-2个正确答案)
1.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)  C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
结论:若对应物起始量等物质的量之比而不等物质的量,平衡时对应物只能同百分含量,而浓度、转化率、反应速率均不等。
[例1]可逆反应A(g)+B(g) 2C(g)在固定容积的容器中进行,a. 如果向容器中充入1mol A和1mol B,在某温度下达到平衡;b. 若向容器中充入1mol C,在同样的温度下达到平衡:(1)C物质平衡浓度 a > b (2) C物质体积分数 a = b
2C(g)在固定容积的容器中进行,a. 如果向容器中充入1mol A和1mol B,在某温度下达到平衡;b. 若向容器中充入1mol C,在同样的温度下达到平衡:(1)C物质平衡浓度 a > b (2) C物质体积分数 a = b
(3) A物质的转化率 a = b (4)平衡时的反应速率 a > b
[例2]在一密闭的容器中充入2mol A和1mol B发生反应:
2A(g)+B(g) xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为( C )
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为( C )
A. 只能为2 B.只能为3 C. 可能为2,也可能为3 D. 无法确定
结论:等温等压,只要对应物起始量等物质的量之比,平衡时对应物就能同浓度、同百分含量、同转化率、同反应速率。记为:等温等压等摩尔比。
若 aA(g) + bB(g)  cC(g)
cC(g)
Ⅰ a mol b mol 0
Ⅱ x y z
Ⅰ、Ⅱ要达成相同平衡必须满足的条件是 =
= 
[例].某恒温恒压下,向可变容积的密闭容器中充入3升A和2升B,发生如下反应: 3A(气)+2B(气)=xC(气)+yD(气) 达到平衡时C的体积百分比为m %,若维持温度,压强不变,将0.6升A,0.4升B、4升C、0.8升D作为起始物质充入密闭容器内,则达到平衡时C的体积百分比仍为m%,则x= 5n ,y= n 。(n为自然数)
结论:等温等容,只要对应物起始量等物质的量,平衡时对应物就能同浓度、同百分含量、同转化率、同反应速率。记为:等温等容等摩。
 若 aA(g) + bB(g)
cC(g)
若 aA(g) + bB(g)
cC(g)
Ⅰ a mol b mol 0
Ⅱ x y z
Ⅰ、Ⅱ要达成相同平衡必须满足的条件是x + z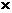
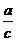 = a 和 y + z
= a 和 y + z = b
= b
[例]在一个体积固定的密闭容器中加入2 mol A和1 mol B,发生反应:
2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为a
mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( D )
3C(g)+D(g),达到平衡时C的浓度为a
mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( D )
A.4molA+2molB B.2molA+1molB+3molC+1molD
C.3molC+1molD+1molB D.3molC+1molD
37.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
36.如右图示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一些镁带,
 再用滴管滴入5ml盐酸于试管中。试回答下列问题:
再用滴管滴入5ml盐酸于试管中。试回答下列问题:
(1) 实验中观察到的现象:
① ;② .
(2)产生上述现象的原因是: .
(3)写出有关离子方程式: .
(4)由实验推知,MgCl2溶液和H2的总能量 .(填大于、小于 或等于)镁带和盐酸的总能量.
35.(1)对于司机酒后驾车,可对其呼出的气体进行检验而查出。所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3 (绿色)+3CH3CHO+6H2O,被检测的气体成分是________________(填名称),上述反应的氧化剂是________________(填化学式),如果有1mol该物质被还原,则反应中共转移了_________________个电子 。
(2)NO是污染大气的有毒气体。为了消除NO的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,这种物质是 。该反应的化学方程式是 。
(3)汽车尾气产生的 可以在一定条件下和
可以在一定条件下和 反应生成无毒物,其反应式可表示为
反应生成无毒物,其反应式可表示为
 ,该反应的氧化剂是________,还原剂是________,每有1mol
,该反应的氧化剂是________,还原剂是________,每有1mol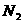 生成,反应中转移的电子为_____mol.
生成,反应中转移的电子为_____mol.
(4)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:
SiO2+2C Si+2CO↑,在该反应中氧化剂是________ __________ ___________,
Si+2CO↑,在该反应中氧化剂是________ __________ ___________,
被氧化的物质与被还原的物质的物质的量之比是____________________ ________。
(5)根据4NH3+ 5O2== 4NO+6H2O的反应方程式,如果反应后得到l mol H2O,则反应中有________mol氮原子被氧化。
34.原电池是一种将 能转化为电能的装置,能构成原电池的物质间一定存在一个能自发的 反应。铜丝和铁丝拧在一起时铁丝更易腐蚀这是因为铁丝相当于是原电池的 极,比纯铁更易 电子;铁在干燥的空气中不易生锈而在潮湿的空气中较易生锈的原因也是形成了原电池,这时正极得电子的物质通常是空气中的 。
废旧电池不能随意丢弃这是因为废旧电池中含有的重金属离子会造成 和地下 的污染,威胁人类的健康。
33.写出下列冶炼金属发生反应的化学方程式:
(1)工业上用一氧化碳还原三氧化二铁冶炼铁
____________________________________________________________________。
(2)铝粉和四氧化三铁混合后加热
____________________________________________________________________。
(3)点燃的镁条伸进氮气中继续燃烧
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com