
题目列表(包括答案和解析)
22.(10分)信息1:碳正离子(例如CH3+、CH5+、(CH3)C+等)是有机反应中重要的中间体。欧拉(G-O·Lab)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖,碳正离子CH3+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得到CH3+。
信息2:CH3COOH是一种弱酸,而氯乙酸ClCH2COOH的酸性强于CH3COOH,这是因为-Cl是一种强吸电子基团,能使-OH上的H原子具有更大的活动性,有的基团具有斥电子基团,能减弱-OH上H原子的活动性,这些作用统称为“诱导效应”。
信息3:含有羟基的化合物可表示为M-OH(M不确定);当它与H+结合时,可形成M-OH2+(有机反应的重要中间体);它在一定条件下,易失去H+或水分子。
(1)相同条件下,下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是________________________;
(2)相同条件下,A CH3CH2OH2+ B NH4+ C HCO3-的酸性由强到弱的次序为(填序号)_____________________
(3)原子数、电子数都相等的微粒称为等电子体,等电子体有相似的几何形状。则符合M-OH2+通式的最简单的离子的电子式是____________,其几何形状为____________________ ;CH3+是反应性很强的正离子,是缺电子的,其电子式为_____________________,它的四个原子是共平面的,三个键角相等,键角应是_________。
(4) (CH3)2CH+在NaOH的水溶液中反应将得到电子中性的有机分子,其结构简式为__________。
(六)问题讨论:
(1)滴定时能否剧烈摇动锥形瓶?为什么?
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?_______(填“是”或“不是”或“可能是”)。制造商最可能采取的做法是__________(填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
21.(8分)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回
答:(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.①某同学用碳棒、铜棒和稀硫酸为原材
料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
(五)数据记录与处理(请在下面设计并画出数据记录和数据处理的表格,不必填数据)。
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是____________mg/L。
(四)实验过程
(1) 洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2) 用 (填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3) 用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视_____________________________,直到滴定终点。滴定至终点时的现象是____________________________________________________________________。
(三)实验用品及试剂
(1) 仪器和用品(自选,略)
(2) 试剂:指示剂______________(填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
19.(14分) 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)
⑵小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;② ③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后
n(Br-)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么?
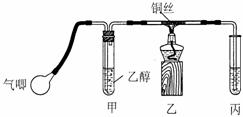 Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
请填写下列空白:
⑴乙醇发生催化氧化的化学方程式为
。
 ⑵实验时,小钱同学将甲装置浸在70℃-80℃的水浴中,目的是
____。
⑵实验时,小钱同学将甲装置浸在70℃-80℃的水浴中,目的是
____。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
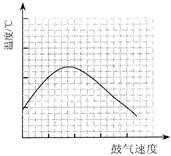
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。
请你解释鼓气速度过快,反应体系温度反而下降的原因: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
20.(11分)维生素C是一种水溶性维生素(其水溶液呈酸性),
它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏
血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的
含量在500mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的
含量,下面是测定实验分析报告。(请填写有关空白)
18、(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
17.(10分)(1)用系统命名法命名下列物质:
①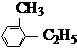 _______________ ②
_______________ ②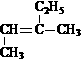 _______________
_______________
(2)书写下列物质的结构简式:
① 3,4-二甲基-3-乙基己烷 ② 间三甲苯
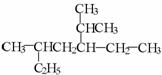
(3)有机物 是某单炔烃经过加成反应得到的,请写出此炔烃
可能的结构简式_________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com