
题目列表(包括答案和解析)
2.下列关于溶液的说法错误的是 ( )
A.饱和溶液析出晶体后,其溶质的质量分数可能不变
B.在溶液里进行的化学反应,通常比较快
C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变
1.下列物质中既存在离子又存在分子的是 ( )
A.氯化钠晶体 B.金刚石
C.氯化钠溶液 D.液氧
3.(3)溶解度曲线的应用
①判断某种物质在不同温度下的溶解度大小。
②比较不同物质在同一温度下溶解度的大小。
③判断物质溶解度受温度影响变化的趋势。
④如何通过改变温度和增加溶质,将不饱和溶液变为饱和溶液。
⑤如何通过改变温度或蒸发溶剂,使溶质从溶液中析出
冲关训练:
基础题:
2.判断溶液是否饱和的方法:
一般说,要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶液。
(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
精题导解:
考点1:溶液
例1:关于溶液的叙述正确的是
A溶液都是无色的 B饱和溶液一定是浓溶液
C糖水的溶质是水 D医用生理盐水是溶液
解析:溶液是均一、稳定的混合物,因此并不是说溶液一定是无色的,因此A是错误的;饱和溶液并不一定是浓溶液,但是同一温度下,同一种溶质的饱和溶液一定比不饱和溶液要浓,故B错误;糖水是蔗糖与水的混合物,根据溶质、溶剂的判定方法,糖水中的容只是蔗糖,因此C错误。因此叙述正确的是D。
答案:D
点拨:溶液中溶质、溶剂的判定应根据判定方法里确定,固体与液体混溶形成的溶液,古体是溶质,液体是溶剂。
考点二:饱和溶液与不饱和溶液之间的转化
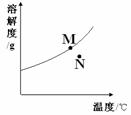 例2:右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)
例2:右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
 解析:根据题中的图示来看,A物质的溶解度受温度的影响很大,从M到N,可以采用升高温度再增加溶剂的方法;而从N到M,可以采用升温再将其蒸发掉部分,因此,正确的是D。
解析:根据题中的图示来看,A物质的溶解度受温度的影响很大,从M到N,可以采用升高温度再增加溶剂的方法;而从N到M,可以采用升温再将其蒸发掉部分,因此,正确的是D。
答案:D
点拨:在解答此题是需要注意的是,在选择方法上要考虑到温度的改变。
考点三:溶解度曲线的意义
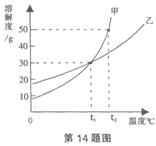
例3:甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
B.t2℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,在lO0g水中放入60g甲,所得溶液溶质的质量分数为37.5%
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
解析:本题注重考查对溶解度曲线理解。在t1℃时,甲、乙两种物质的溶解度相同,均为30g,因此甲、乙各30g分别加入70g水中并不能恰好完全溶解,而是都剩余了一部分,因此A项错误。t2℃时,甲和乙的溶解度不相同,因此二者的饱和溶液中溶质的质量分数不相同,故B错误。t2℃时,甲的溶解度为50g,把60g甲物质放入100g水中会形成150g的饱和溶液,此时其溶质质量分数为33.3%,故C错误。根据甲、乙的溶解度曲线的示意图来看,t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,首先饱和的是甲物质,因此D是正确的。
点拨:解答本题需明确掌握溶解度曲线的意义及其变化的规律。要分清曲线上的点、曲线上方和下方的点以及不同曲线的焦点的含义。
考点四:溶液的配制
例4:要配制100g 溶质质量分数为10%的氯化钠溶液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
解析:在称量固体药品时,固体应放在干净的纸上或者时一定容器内,而不是直接放在托盘天平上。在量取液体时,视线要与量筒内凹液面的最低处保持水平。在对固体物质进行溶解时,应该用玻璃棒搅拌而不是温度计。因此正确答案为D。
答案:D
点拨:溶液配制是近几年来中考的热点之一,主要体现在溶液配制的步骤、方案、仪器的使用等方面。
方法指引:
1、溶液中溶质、溶剂的判定
(1)固体、气体溶于液体时,固体、气体是溶剂;
(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3.溶解度曲线
(1)溶解度曲线的意义:
①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
(2)溶解度曲线变化的规律
大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
2.影响固体溶解度大小的因素
(1)溶质、溶剂本身的性质
(2)温度
1.概念:
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
1,概念:
(1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
2.饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化:
饱和溶液 不饱和溶液
不饱和溶液
1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。
2,溶液的特征
(1)均一性:是制溶液各部分组成、性质完全相同。
(2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com