
题目列表(包括答案和解析)
18. , 。
17.① 、 、 。(填元素符号)
② 、 、
③A. 、B.
C.
22.(6分)某固体仅由一种元素组成,其密度为5.0g∕cm¯ 3。用X射线研究该固体的结构时得知:在边长为10¯ 7cm的正方体中含有20个原子,则此元素的相对原子质量是多少?
高二年级第一学期期中考试
化学试卷答卷纸
21.(6分)将100g含(C6H10O5)n90%的淀粉(杂质不参与反应)水解为葡萄糖(水解率为90%),再将葡萄糖发酵制成乙醇,再将乙醇中的一部分氧化为乙酸。生成的乙酸恰好与未
被氧化的乙醇完全反应生成乙酸乙酯。求可制得乙酸乙酯多少克?
20.(12分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)_______________________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________ ;若物质Na2R是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式_________________。
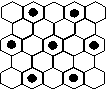 (3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___
。
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___
。
(4)下面二维平面晶体所表示的化学式为AX3的是 ( )
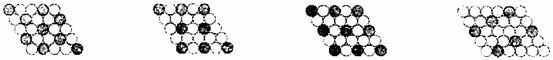
A B C D
19.(14分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1) 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:
_________<X<_________。
(2) 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是 ;简述元素电负性X的大小与元素金属性、非金属性之间的关系________________________。
(3) 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是 。
18.(4分) A、B是短周期元素,原子最外层电子排布式分别为mSx、nSxnpx+1。A与B形成的离子化合物加水溶解后可使酚酞溶液变红,同时有气体C逸出,该气体可使湿润的红色石蕊试纸变蓝。则该离子化合物的化学式为 ,气体C的电子式为 。
17.(18分) A、B、C三种短周期元素,原子序数依次增大,三种元素序数之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①A、B、C三种元素分别是_________ 、 _________ 、_________。
②A、B、C之间任取两种能形成多种化合物,其中属于离子化合物的化学式分别为_________ 、 __________ 、___________
③分别写出A、B、C的电子排列式:
A._____________________、B._____________________、C._____________________
16.根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是
A Q和R B S和T C T和U D R和T E R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是
A Q2++2e-→Q B R2++2e-→R C S3++3e-→S
D T3++3e-→T E U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是
A QCl2 B RCl C SCl3 D TCl E UCl4
(4)S元素最可能是
A S区元素 B 稀有气体元素 C p区元素 D 准金属 E d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是
A 硼(1s22s22p1) B 铍(1s22s2) C 锂(1s22s1) D 氢(1s1) E 氦(1s2)
第Ⅱ卷(共60分)
15.组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中能代表晶体结构特征的最小重复单位称为晶胞。在冰晶石(Na3AlF6)晶胞中,AlF63-占据的位置相当于NaCl晶胞中C1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
A.2:1 B.3:2 C.5:2 D.5:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com