
题目列表(包括答案和解析)
26、(6分)在0.2mol/L氨水中存在着下列平衡:NH3+ H2O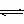 NH3·H2O
NH3·H2O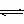 NH4+ +OH-,当改变条件时,表中各项内容有何变化:
NH4+ +OH-,当改变条件时,表中各项内容有何变化:
|
改变条件 |
平衡移动方向 |
PH值 |
C(NH4+)
|
|
通入氨气至饱和 |
|
|
|
|
加入少量盐酸 |
|
|
|
|
加入少量NH4Cl |
|
|
|
|
加水稀释 |
|
|
|
25、(4分)把AlCl3 溶液蒸干后再灼烧,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)____________________________
_____ __。
24、(9分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_______________________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
23.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
_____________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪
些假设或猜想(列出两种即可)?
假设一:________________________________________________________________________
假设二:________________________________________________________________________
22. (4分)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
(4分)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:

但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是 ( )
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
21.(8分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据(1)弱碱在水中存在电离平衡。(2)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(1)的实验方法及现象_____________________。
(2)应用根据(2)的实验方法及现象_____________________。
20.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在101KPa ,1mol纯物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
D.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
19.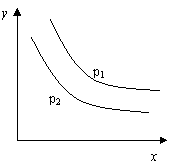 反应:L(s)+aG(g)
反应:L(s)+aG(g) bR(g) 达到平衡时,
bR(g) 达到平衡时,
温度和压强对该反应的影响如图所示:图中压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a<b
18、pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
17、某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com