
题目列表(包括答案和解析)
32. (5分)为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:

(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_________________ _______________________________________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是_______________________________
__________________________________________________________________________________
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应的方法 。
31.(10分)
(1)在实验室制取乙烯的装置图(如下图)中,仪器A的名称是________.A中加入的两种试剂是____________________________.反应方程式为_____________________________.
乙烯的收集方法为________________________;
(2)将反应产生的乙烯通入酸性高锰酸钾溶液中,观察到的现象是
____________________________________;将反应产生的乙烯通入溴的四氯化碳溶液中,观察到的现象是____________________________________,反应的化学方程式为__________________________________________________________.
(3)反应进行一段时间后,A中混合液常变黑,并有刺激性气味的气体生成,该气体是________,若要验证有该气体生成,应将生成的气体通过________溶液;若要除去该气体应将生成的气体通过________溶液.
30、(8分)如图所示
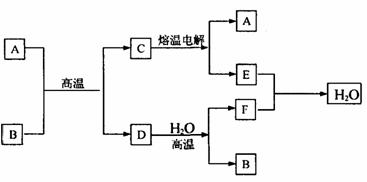
已知A、D、E、F是中学化学中的常见单质,B、C是氧化物,且B的式量是232。请填空:
(1)A是 ,E是 。(填化学式)
(2)D跟水反应的化学方程式是 。
 (3)C电解时,每生成1molA同时生成
molE。
(3)C电解时,每生成1molA同时生成
molE。
(4)先将B溶于足量盐酸,再在用盐酸溶解后的溶液中通人足量Cl2,请写出全过程中有关反应的离子方程式: 。
29、(3分)联苯 的二溴代物有多种,其中两个溴原子位置对称的有五种, 并且碳碳单键能够旋转,如
的二溴代物有多种,其中两个溴原子位置对称的有五种, 并且碳碳单键能够旋转,如




(1)请写出另外两种二溴代物的结构简式: 、 。
(2) 与
与 的相互关系是
的相互关系是
A.同分异构体 B.同系物 C.同一物质
28.(4分)
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A、(CH3)2C=C(CH3) 2 B、CH3CH=CH CH3
C、CH2=CH2 D、CH2=CHCl
27.(8分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式 ____________ 。
(2)已知分子式为 C6H6 的结构有多种,其中的两种为

① 这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能_______(选填a、b、c、d,倒扣分)而Ⅰ不能
 a 被酸性高锰酸钾溶液氧化 b 与溴水发生加成反应,
a 被酸性高锰酸钾溶液氧化 b 与溴水发生加成反应,
c 与溴发生取代反应 d 与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:
Ⅰ需______mol,而Ⅱ需_______mol。
② 今发现 C6H6 还可能有另一种如右图立体结构:该结构的二氯代物有_______种。
(3)烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3-环己二烯( )脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
(填稳定或不稳定)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
(填稳定或不稳定)。
 (4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号)
(4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号)
a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
(5)现代化学认为苯分子碳碳之间的键是 。
26.(8分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” 下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
25.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A. 9.0 B. 9.5 C. 10.5 D. 11.5
第Ⅱ卷(非选择题,共50分)
23、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法不正确的是
A 正极反应式为:O2+2H2O+4e-=4OH-
B 电池工作时,电流由铝电极沿导线流向铂电极
C 以网状的铂为正极,可增大与氧气的接触面积
D 该电池通常只需更换铝板就可继续使用
24.右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析
不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol/(L•min)
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
22、下列关于电解质溶液的叙述正确的是 ( )
A 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com