
题目列表(包括答案和解析)
5. 在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
度增大,应采取的措施是 ( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
4.下列叙述中,能证明某物质是弱电解质的是 ( )
A.熔化时不导电 B.不是离子化合物,而是极性共价化合物
C.水溶液的导电能力很差 D.溶液中已电离的离子和未电离的分子共存
3.下列物质中属于电解质,但在给定条件下不能导电的是 ( )
A.稀硫酸 B.液态溴化氢 C.铝 D.蔗糖
⒈下列物质中,属于纯净物的是 ( )
A. 碱石灰 B.铝热剂 C.赤铁矿 D.冰晶石
2.高炉炼铁时,加入石灰石的主要作用是 ( ) A.除去硫和磷 B.形成合金 C.除去碳 D.做为助熔剂
28.计算题:
A、B、C三种烃的衍所含元素的质量分数都为C:40%、H:6.7%、O:53.3%。又知在标准状况下,A蒸气的密度为1.34g/L;在同温同压下,B、C的蒸气密度都是A的2倍,且A能发生银镜反应;B显酸性;C显中性,C能与氢氧化钠溶液反应生成醇和盐。
(1)通过计算,求A、B、C的分子式
(2)根据A、B、C的性质,确定它们的结构,并写出它们的结构简式
[解]ACH2O;B和C:C2H4O2
27. 化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间产体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图示的反应。
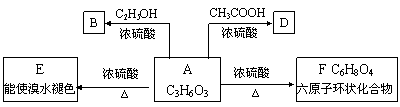
试写出:(1) 化合物的结构简式
A____________________ B____________________ D____________________
(2) 下列反应的化学方程式,并注明反应的基本类型
 A
E_____________________________反应基本类型________________
A
E_____________________________反应基本类型________________
 A
F________________________________反应基本类型________________
A
F________________________________反应基本类型________________
[解]
26.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,易溶于醇、醚、丙酮等有机溶剂,在实验中可以用下图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写以下空白。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式
, 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象________。
(3)容器c中NaOH溶液的作用是__________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓H2SO4混合液的量,比正常情况超过许多。如果装置的气密性没有问题,试分析其可能的原因。
[解]
(1)CH3CH2OH
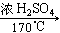 CH2=CH2↑+H2O、H2C=CH2+Br2→CH2Br-CH2Br
(2)b中水面会下降,玻璃管中的水面会上升,甚至溢出
(3)除去乙烯中带出的酸性气体(SO2、CO2等)
(4)①乙烯反应速度过快;②实验过程中乙烯和浓H2SO4的混合液没有迅速达到170℃(或写“控温不当”)。
CH2=CH2↑+H2O、H2C=CH2+Br2→CH2Br-CH2Br
(2)b中水面会下降,玻璃管中的水面会上升,甚至溢出
(3)除去乙烯中带出的酸性气体(SO2、CO2等)
(4)①乙烯反应速度过快;②实验过程中乙烯和浓H2SO4的混合液没有迅速达到170℃(或写“控温不当”)。
25.为测定某卤代烃分子中所含有的卤原子的数目和种类,可按下列步骤进行实验:① 量取该卤代烃液体11.4 mL;② 加入适量氢氧化钠溶液,煮沸至液体不分层;③ 冷却后加入稀硝酸酸化;④ 加入硝酸银溶液至沉淀完全;⑤ 过滤,洗涤沉淀并干燥;⑥ 称取干燥后的沉淀的质量。
回答下列问题:
(1)加入氢氧化钠溶液的目的是____________________________________
(2)加入过量硝酸银溶液的目的是___________________________________
(3)若加入硝酸银溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是_____________
24.以前城市居民所使用的燃料主要是管道煤气,“西气东输”后,天然气开始作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
2CO+O2 2CO2 2H2+O2
2CO2 2H2+O2 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填增大或减小),如不作改进可能产生的不良结果是 管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
|
|
乙烷 |
丙烷 |
丁烷 |
|
熔点(℃) |
-183.3 |
-189.7 |
-138.4 |
|
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是 。
[解]24.(8分)天然气(2分); 增大(2分);不能充分燃烧,生成有毒的CO(2分);
丁烷遇冷凝结为液体使管道内气流不畅(2分)。
23.完成下列化学方程式或离子方程式,并指明反应类型
(1)苯酚与NaOH溶液反应(写离子方程式)_______________________________ 反应类型______________
(2)硬脂酸甘油酯与NaOH溶液共热_____________________________________ 反应类型______________
(3) 加入NaHCO3溶液中______________________________________ 反应类型______________
加入NaHCO3溶液中______________________________________ 反应类型______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com