
题目列表(包括答案和解析)
5.1mol金属镁在空气中燃烧,所得固体的质量是( )
A.40g B.略大于40g C.略小于40g D.无法判断
4.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加足量盐酸,如果放出等体积的氢气(同温同压),两份铝粉的质量之比为( )
A.1∶2 B.1∶3 C.3∶2 D.1∶1
3.某无色透明溶液,能与铝作用放出氢气,此溶液中可以大量共存的离子组是( )
A.H+、Mg2+、Cl―、Ba2+
B.SO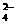 、Na+、HCO
、Na+、HCO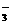 、K+
、K+
C.Cu2+、OH―、SO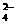 、Fe2+
D.NO
、Fe2+
D.NO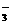 、OH―、Cl―、Ba2+
、OH―、Cl―、Ba2+
2.下列离子反应方程式正确的是( )
A.铝溶解在NaOH溶液中:2Al + 2OH― + 2H2O
== 2AlO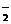 + 3H2↑
+ 3H2↑
B.氨水滴入AlCl3溶液中:Al3+ + 3OH― == Al(OH)3↓
C.MgO溶于稀HCl中:O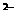 + 2H+ == H2O
+ 2H+ == H2O
D.Al(OH)3溶于稀H2SO4中:OH― + H+ == H2O
1.工业上制取镁粉是将镁的蒸气进行冷却,冷却的最好方法是( )
A.在N2中冷却 B.在H2中冷却 C.在水中冷却 D.在CO2中冷却
32.(6分)今有稀盐酸和稀硫酸混合液100ml,当加入8.55g氢氧化钡粉末充分反应后过滤,干燥得沉淀4.66g,所得溶液PH=13(设反应后溶液体积仍为100mL)
(1)求原混合液中SO42-的物质的量浓度
(2)求原混合酸中Cl-的物质的量浓度
(3)在滤液中加入足量铝粉,写出反应的化学方程式,并计算在标准状况下产生的氢气多少升?
31.(4分)现有铝铁合金粉末13.9g,投入500mL2mol/L的稀盐酸里充分反应后,剩余的盐酸用50mL6mol/L的NaOH溶液恰好中和,求铝、铁的百分组成。(计算结果保留一位小数)
30.用下面两种方法可以制得白色的Fe(OH)2沉淀
方法一.用不含Fe2+的FeSO4溶液与用不含O2的
 蒸馏水配制的NaOH溶液反应制备。
蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时
还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含
O2的NaOH溶液,插入FeSO4溶液液面下,再挤
出NaOH溶液。这样操作的理由是 。
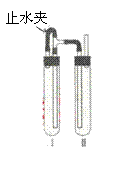
方法二.在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
。
29.(5分) 某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。 甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。 乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。 另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
28.(5分)铝片的表面有一层保护膜,成份是_______(填化学式),除去保护膜的铝片涂以
Hg(NO3)2溶液后,铝片上产生少量的___________,将此铝条放置空气中片刻后表面出现________________现象,此反应方程式为___________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com