

题目列表(包括答案和解析)
12、在理论上可用于设计原电池的化学反应是 [ ]
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g) △H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0
C.CaC2(s)+2H2O(1) = Ca(OH)2(s)+C2H2(g) △H <0
D.HCl(aq)十NaOH(aq) = NaCl(aq) + 3H2O(l) △H <0
11、相同温度下,将足量的AgCl分别放入下列溶液中:
① 40mL 0.02mol/L BaCl2溶液 ② 40mL 0.03mol/L 盐酸
③ 10mL 蒸馏水 ④ 50mL0.05mol/L AgNO3溶液
则AgCl的溶解度大小顺序为[ ]
A.① = ② = ③ = ④ B. ③ > ② > ① > ④
C.④ > ② > ① > ③ D. ③ > ① > ② > ④
10、在室温下,将pH=3 的酸和pH=11 的碱等体积混合,混合后溶液的pH 小于7 。则该
酸和碱的组合可以是[ ]
A.硝酸和氢氧化钡 B.盐酸和氨水 C. 硫酸和氢氧化钾 D.醋酸和氢氧化钠
9、下列各组数据中,前者一定比后者大的是[ ]
A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-)
B.浓度均为0.1mol·L-1的(NH4)2SO4溶液和(NH4)2CO3溶液中的c(NH4+)
C.0.1mol·L-1的Na2CO3溶液中c(HCO3-)和c(OH-)
D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量
8、下列关于电解质溶液的叙述正确的是[ ]
A.常温下,NH4Cl与某物质的混合溶液pH<7,则其组成可能是NH4Cl与HCl或NH4Cl与NH3•H2O
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液所含的粒子种类较多
D.将一元酸HA溶液与一元碱BOH溶液等体积混合,若所得溶液呈酸性,则混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
7、超酸是指酸性比普通无机酸强106∽1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是[ ]
A.碱性 B.酸性 C.还原性 D.氧化性
6、广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是[ ]
A.CaO2的水解产物是Ca(OH)2和H2O2 B. NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
5、弱酸HY溶液的pH=3.0,将其与等体积水混合后的pH范围是(已知lg2=0.3 ) [ ]
A. 3.0-3.3 B. 3.3-3.5 C. 3.5-4.0 D. 3.7-4.3
4、 反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是[ ]
反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是[ ]
A.容器内压强不再改变 B.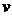 (H2O)=
(H2O)=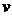 (H2)
(H2)
C.气体的密度不再改变 D.反应不再进行
3、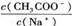 欲使CH3COONa稀溶液中的值增大,可采取的措施是
[ ]
欲使CH3COONa稀溶液中的值增大,可采取的措施是
[ ]
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体Na2CO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com