
题目列表(包括答案和解析)
23、(6分)(1)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括 ,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合化学方程式简要说明) 。
(2)过氧化氢( H2O2)是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。H2O2是一种二元弱酸,请写出它的第二步电离方程式 ,向H2O2溶液中加入过量Ba(OH)2溶液, 反应的化学方程式________________________。
22、(7分)有如下化学反应:2A(g)+B(g) 2C(g) △H<0。
2C(g) △H<0。
(1)将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_____________。
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________(精确到0.1%);若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施(写两种)_ __ _______。
21、实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4-5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1 C2。
②当Na2CO3中含有NaOH时,则C1 C2。
20、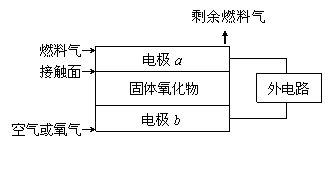 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是[ ]
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是[ ]
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
第Ⅱ卷(非选择题 共40分)
19、以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是[ ]
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是[ ]
A.该滴定反应可以表示为:SO32- + SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
18、对于可逆反应m A(g) + n B(g)  pC(g)
+ g D(g),若其它条件都不变,只是在反应前加入合适的催化剂,则两种v-t图像如下图。
pC(g)
+ g D(g),若其它条件都不变,只是在反应前加入合适的催化剂,则两种v-t图像如下图。

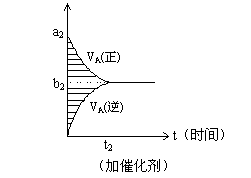
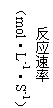
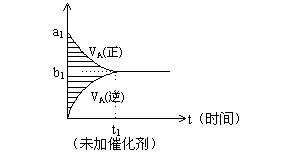
①a1 = a2 ②a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1>t2 ⑥t1= t2
⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
以上正确的为[ ]
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
16、2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生如下的反应:
PCl3(g)+Cl2(g)  PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是[ ]
PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是[ ]
A. 0.40mol B. 0.20mol C. 小于0.20mol D. 大于0.20mol,小于0.40mol
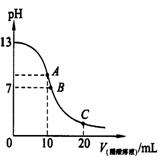 17、25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是[ ]
17、25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是[ ]
A.在A点: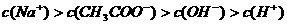
B.在B点: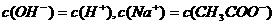
C.在C点: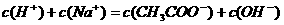
D.在A点: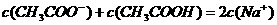
15、己知 CuS04 溶液分别与 Na2C03 溶液、Na2S 溶液的反应情况如下:
(1) CuS04 十 Na2C03 主要 : Cu2+ + C032- + H20 == Cu(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CuS04 + Na2S 主要 : Cu2+ + S2- == CuS ↓
次要 : Cu2+ + S2- + 2H20 == Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中,正确的是[ ]
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
14、一定能在下列溶液中大量共存的离子组是[ ]
A.pH=0的溶液:Fe2+、Mg2+、NO3-,SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
13、氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可供航天员饮用,其电极反应如下:负极:2H2+4OH--4e-=4H2O 正极:O2+2H2O+4e-=4OH- 当得到1.8L饮用水时,电池内转移电子物质的量约为[ ]
A.1.8mol B.3.6mol C.100mol D.200mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com