
题目列表(包括答案和解析)
6.利用金属M(活泼性比氢强)和石墨棒N构成原电池,电解质溶液为稀硫酸,关于此装置的下列说法中正确的是
A.M为正极,N为负极 B.导线上有电流通过,电流的方向从M→N
C.反应后,M极质量减小 D.M极上发生还原反应
5.下列物质的命名不正确的是
A.2-甲基丙烷 B.2,3,3-三甲基丁烷
C.1-丁烯 D.异丁烷
4.下列关于金属元素的叙述正确的是
A.金属元素单质只有还原性,其离子只有氧化性
B.金属元素的单质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.金属元素的单质均为电的良导体
3.一定温度下,反应N2(g)+3H2(g)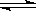 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.混和气体中N2、H2和NH3的质量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每减少1molN2,同时增加2molNH3
2.可以判断某酸是强电解质的依据是
A. 该酸加热至沸腾也不分解 B. 该酸可溶解氧化铜
C. 该酸可跟石灰石反应,放出CO2 D. 该酸浓度为0.001mol·L-1时其pH小于3
1.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是
A. 铜和稀硝酸反应 B.氮气和氧气发生反应
C. 氨的催化氧化 D. 二氧化氮气体溶于水
31.(5分)
氨氧化法制硝酸的生产过程中,如果由氨制一氧化氮的转化率为96% ,而一氧化氮转化为硝酸的产率为92% 。现用10 t 氨按上述情况可制得50%的硝酸多少吨?
30.(6分)
在一定温度下,发生如下反应: N2 +3H2  2NH3 起始时充入的N2 和 H2 的物质的量分别是3.0 mol和6.0 mol,平衡时,生成NH3的物质的量是2.4 mol.已知容器的容积为5.0 L,试求:
2NH3 起始时充入的N2 和 H2 的物质的量分别是3.0 mol和6.0 mol,平衡时,生成NH3的物质的量是2.4 mol.已知容器的容积为5.0 L,试求:
(1)H2 的转化率.
(2)平衡时混合气体中N2 的体积分数.
29.某同学在实验室制氨气时进行下列实验设计。
(1)实验室制氨气的原理(写化学方程式): ,氨气的电子式为: ,氨气分子的空间构型是: 。
(2)实验室制氨气的发生装置与制 气体完全相同。(填化学式)
(3)将制备的氨经 干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)
。
28.(6分)
硝酸可使许多种非金属氧化,例如把一红热木炭放到浓硝酸中,可有剧烈反应,化学方程式为_________________________ ;
(1)把产生的气体直接通入石灰水中现象________________________________。
(2)把产生的气体经水洗后再导入澄清的石灰水中,可以观察到的现象是__ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com