

题目列表(包括答案和解析)
5.加热装有1molHI气体的定容密闭容器,发生如下反应:2HI(g) H2(g) + I2(g);△H>0,在t1℃反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2molHI,在t2℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是
H2(g) + I2(g);△H>0,在t1℃反应达到平衡时,I2的物质的量分数为x1;若起始时在该容器中加入2molHI,在t2℃达到平衡时,I2的物质的量分数为x2;则下列关系正确的是
A.若t1 = t2,则x1 < x2 B.若t1 = t2,则x1 < x2
C.若t1 < t2,则x1 = x2 D.若t1 < t2,则x1 < x2
4.某温度下,在一容积可变的等压容器中,反应2A(g) + B(g) 2C(g)达到平衡时,A、B和
C的物质的量分别是4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中的三者物质的量作如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和
C的物质的量分别是4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中的三者物质的量作如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
3.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动 B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
2.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g) 2HI(g);△H<0.达到平衡后,下列说法不正确的是
2HI(g);△H<0.达到平衡后,下列说法不正确的是
A.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
B.恒温时,减小容积平衡不移动,但气体颜色加深
C.恒容时,通入H2,I2的质量分数减小
D.恒压时,通入HI气体,刚开始时正反应速率会减小
1.在一密闭容器中充入一定量的H2和N2发生反应N2(g)+3H2(g) 2NH3(g),经测定3秒末的氢气的反应速率为0.3mol·(L-1·S-1)),则6秒末NH3的浓度为
2NH3(g),经测定3秒末的氢气的反应速率为0.3mol·(L-1·S-1)),则6秒末NH3的浓度为
A.1.2mol/L B.大于1.2mol/L C.小于1.2mol/L D.不能确定
33.为了证明一水合氨是弱电解质,甲、乙、丙三名学生分别选用下列试剂进行实验:0.10 mol·L-1氨水、0.1 mol·L-1 NH4Cl 溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol·L-1氨水pH为10, 则认定一水合氨是弱电解质,你认为这一方法是否
正确?_________(填“是”或“否”),并说明理由:
(2)乙取出10 mL 0.10 mol·L-1 氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足的关系用含a、b等式或不等式表示______________________________
(3)丙取出10 mL 0.10 mol·L-1 氨水,滴入 2 滴酚酞试液,显粉红色,再加入CH3COONH4晶体少量(提示:CH3COONH4溶于水时醋酸根离子和铵根离子的水解程度相当),氨水的颜色变(填“深”或“浅”) ______________;你认为这一方法 (填“能”或“否”)证明一水合氨是弱电解质.
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明一水合氨是弱电解质:
32.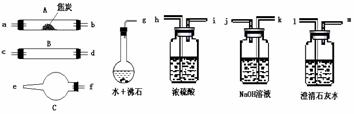 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)回答下列问题:
水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)回答下列问题:
⑴盛浓硫酸的装置的用途是
盛NaOH溶液的装置的用途是
⑵仪器B中需加入试剂的名称(或化学式)是: ,
所发生反应的化学方程式是: 。
⑶仪器C中加试剂的名称(或化学式)是 ,
其目的是 。
⑷按气流方向连接各仪器,用字母表示接口的连接顺序:g-ab
⑸能证明混合气中含有CO的实验依据是 。
能证明混合气中含H2的实验依据是 。
31.在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,如氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子间可以形成链状结构,氮原子间也可形成链状结构,假设氮、氢原子间只以N-N键或N-
H键形式连接,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的NH3对农业、化学和国防工业具有重要意义。其合成原理是:N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
2NH3(g);△H=-92kJ/mol。
①在一定温度下,将1molN2和4molH2气体通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内的压强为起始时的80%。此时反应放出的热量为 。
②保持温度不变,在相同的容器中,将起始时刻物质的量设为amolN2、bmolH2和cmolNH3,欲使平衡时NH3的物质的量分数为25%,则
I.达到平衡时,①与②放出的热量 (填字母)
A.一定相等 B.前者一定小于后者 C.前者等于或小于后者 D.前者等于或大于后者
II.若该反应正向进行,则a的取值范围是 。
30.向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的庄强为起始时的1.2倍,则用Y的物质的量浓度变化表示
的速率为 mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3. 5mol/L·min; 乙v(Y)=2mol/L·min; 丙v(Z)=4.5mol/L·min; 丁v(X)=0. 075
mol/L·s 。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不 移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较
A.无法确定 B.⑷一定大于⑴ C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)
的平衡等效,则a、b、C应该满足的关系为
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)
的平衡等效,且起始时维持化学反应向逆反应方向进行,则C的取值范围应该为
29.已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性,0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性,请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),原因是
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸,此反应的氧化剂是 ,反
应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com