
题目列表(包括答案和解析)
1.下列物质的水溶液能导电,但属于非电解质的是
A.HClO B.Cl2 C.NH4HCO3 D.SO2
34.25℃时,若pH=a的10体积的某强酸溶液与pH=b 的1体积的某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系是 。
33.现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、
HCO3-、Cl-等离子,请按要求填空:
⑴在水溶液中,该离子水解呈碱性的是: 。
⑵在水溶液中,该离子水解呈酸性的是: 。
⑶既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有:
⑷既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有:
32.右图为周期表的一小部分,A、B、C、D、E的位置关系如图
所示。其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中
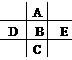
含氧60%,回答下列问题:
(1)A的质量数是____,位于第_____周期,第_____族。
(2)分别写出以下最高价氧化物对应水化物:
B C E
B、C、E三种元素的气态氢化物其稳定性由强到弱砌的顺序是
31.如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如
下反应:2SO2(g)+O2(g) 2SO3(g);△H<0。
2SO3(g);△H<0。
当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
(1)在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线;
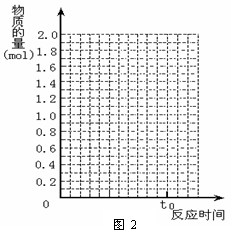 (2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3 时间时 (t3>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ________2.1 mol(填“<”、“>”或“=”)。
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3 时间时 (t3>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ________2.1 mol(填“<”、“>”或“=”)。
(3)若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度
不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x
的值为__________。
30.有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol
B,向乙中通入1.5mol A、0.5mol B和3molC和2molD,将两容器的温度恒定在770K,使反应3A(g)+B(g) xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。
(3)若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是
②若加入0.6molA和0.2molB,则C和D起始物质的量分别应满足 ,
 (4)若平衡时两容器中的压强不相等,则两容器中压强之比为 : 。
(4)若平衡时两容器中的压强不相等,则两容器中压强之比为 : 。
29.已知可逆反应CO (g)+ H2O(g) CO2
(g)+ H2(g),达到平衡时,K =c (CO2)×c (H2)/c (CO)×c (H2O),K是常数,只与温度有关,与浓度无关。
CO2
(g)+ H2(g),达到平衡时,K =c (CO2)×c (H2)/c (CO)×c (H2O),K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为 。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是____________________ _;②当a = b时,a = c。
28.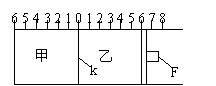 (I)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
(I)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处, 则a的取值
范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物
质的量为 mol,乙中C的转化率 50%(填:“>”、“<、”“=”),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
27.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 (g) N2O4(g);△H<0)
N2O4(g);△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<、”“=”);若打开活塞K2,气球B将__________(填:“变大”、“变小”、“不变”)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填“增大”或“减小”、“不变”);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将 (填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________ 。
26.下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③∶④)是:①1mol/L的盐酸;②0.1 mol·L-1的盐酸;③0.01 mol·L-1的NaOH溶液;④0.001mol/L的NaOH溶液
A.1:10:100:1000 B.0:1:12:11 C.14:13:12:11 D. 14:13:2:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com