
题目列表(包括答案和解析)
29.有pH=1的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是 (用>、<、=表示,下同)。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是 ;反应过程中放出H2的速率依次为υ/1、υ/2、υ/3,则其关系是
28. 313K时,纯水中的KW=3.8×10-14,则在该温度下,c(H+)=10-7mol/L的某溶液,呈 (选填“酸性”,“中性”,“碱性” )
27.在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) CO2(g)十H2 (g);△H<0.
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g);△H<0.
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min)

t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
24.A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。 (1)写出下列元素的符号:A__________,D__________,E___________。
(2)B的单质在F的单质中的现象是 ,
化学方程式是 。 (3)A、C两种元素最高价氧化物的水化物的离子方程式是 。 25.下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石蕊试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
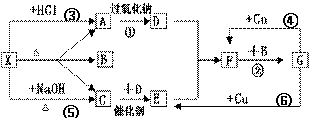 ⑴化学式:X
,C
,
⑴化学式:X
,C
,
F ,G 。
⑵反应④的化学方程式是:
;
⑶C和D反应的化学方程式:
⑷反应⑤的化学方程式
 26.在如图所示的三个容积相同的容器①、②、③中进行如下的反应:
26.在如图所示的三个容积相同的容器①、②、③中进行如下的反应:
3A(g)+B(g) 2C(g) △H<0.
2C(g) △H<0.
(1)若起始温度相同,分别向三个容器中充入3molA
和1molB,则达到平衡时各容器中C物质的百分含量由大
到小的顺序为__________________(填容器编号)(不考虑
活塞质量和摩擦系数) ①外有隔热套 ② ③活塞可移动
(2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3 molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
22.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);△H<0,有下列判断中正确的是:
cC(g)+dD(g);△H<0,有下列判断中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,(a+b)>(c+d)
D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
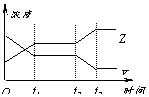 [ ]23.今有反应2X(g)+Y(g)
[ ]23.今有反应2X(g)+Y(g) 2Z(g);△H<0右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
2Z(g);△H<0右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
A.升高温度或降低Y的浓度 B.加入催化剂或增大X的浓度
C.缩小体积或降低X的浓度 D.降低温度或增大Y的浓度
18.甲、乙两容器都发生反应 2A(g)+ B(g) xC(g),
xC(g),
两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,
达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4 molA,0.7 molB 和 0.6 molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2 B.若甲、乙两容器均为恒压容器,则x必等于3
C..若甲为恒容容器、乙为恒压容器,且 x= 3,则 n1必大于n2
D若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2
[
]19在容积固定的密闭容器中存在如下反应: A(g) + B(g)  3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
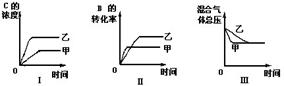 下列判断一定错误的是
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
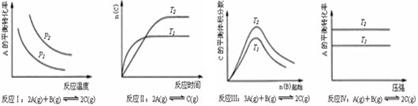 [ ]20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是
[ ]20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1<T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
 [ ]21.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)
[ ]21.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不同
D.平衡时Ⅰ容器的体积小于V L
16.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
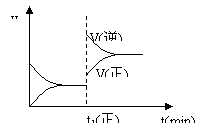 [ ]17.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
[ ]17.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) 2SO3(g) ; ΔH<0
2SO3(g) ; ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ; ΔH<0
4NO(g)+6H2O(g) ; ΔH<0
C.H2(g)+I2(g) 2HI(g) ; ΔH>0
2HI(g) ; ΔH>0
D.C(s)+H2O(g) CO(g)+H2(g); ΔH>0
CO(g)+H2(g); ΔH>0
15.将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时,都将引起
A.溶液的pH增加 B.溶液中的c(H+)增大 C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
14.下列公式哪一个能用来精确地计算任意浓度的HCl水溶液中的总c(H+)=( ) (KW为水的离子积常数)
A.c(H+)=c(HCl) B.c(H+)=c(HCl)+KW/c(H+)
C.c(H+)=c(HCl)+KW D. c(H+)=c(HCl)-KW/c(H+)
13.对于反应2A(g)+xB(g) 4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
A.1 B.2 C.3 D.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com