
题目列表(包括答案和解析)
6、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ② K+、Mg2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
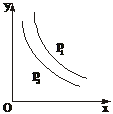
5、反应:L(s)+aG(g) bR(g)达到平衡,温度和压强对该反应的
bR(g)达到平衡,温度和压强对该反应的
影响如右图所示,图中:压强p1>p2,x轴表示温度,y轴表示平
衡混合气体中G的体积分数。据此可判断
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. 无法确定a、b的大小
4、下列说法不正确的是
A.体系有序性越高,熵值就越低 B.知道了某过程有自发性之后可预测过程完成的快慢
 C.吸热反应不一定不能自发进行 D.同种物质气态时熵值最大
C.吸热反应不一定不能自发进行 D.同种物质气态时熵值最大
3、在100℃时,水的离子积为1×10-12,此时纯水中c(H+)=1×10-6,pH=6。则纯水在该温度下显
A.酸性 B.碱性 C.中性 D.无法确定
2、对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂
1、下列物质中属于弱电解质的是
A.醋酸 B.氯气 C.蔗糖 D.碳酸钙
23.(5分)某烃含碳的质量分数为90.6%,其蒸气密度为相同条件下H2密度的53倍。
该烃能使酸性KMnO4溶液褪色,不能使溴水因化学反应而褪色,则其分子式为 ;
若该烃硝化时,一硝基取代物只有二种,则该烃的结构简式为 。
21.(8分)白色固体Y既可溶于盐酸,又可溶于NaOH溶液。根据以下化学反应框图填空:(部分反应产物己略去)
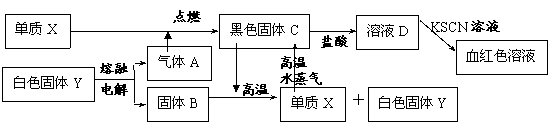
(1)写出下列物质的化学式:X__________________,Y________________;
(2)写出Y溶于NaOH溶液的离子方程式: _________________________________________;
(3)写出B和C反应的化学方程式: _______________________________________________;
(4)写出X与水蒸气反应的化学方程式: _____________________________________________;
22(12分)有某种含有少量氯化亚铁杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采取以下步骤进行:
①准确称量m g样品(在2~3 g范围内)。
②向样品中加入10 mL 6 mol·L-1盐酸,再加入蒸馏水,配制250 mL溶液。
③量取25 mL操作②中配得的溶液,加入3 mL溴水,加热使反应完全。
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全。
⑤过滤,将沉淀洗涤、灼烧、冷却、称量,反复操作至恒量。
根据以上叙述,回答:
(1)在称量样品时,若称量前天平的指针偏向标尺左方,称量读数时,指针刚好在标尺中央,所得样品质量是____________(填编号)。A.比m g多 B.比m g少 C.恰好m g
(2)溶解样品时要加入盐酸,原因是______________________________________________。
(3)加入溴水后,发生反应的离子方程式为________________________________________。
(4)加入氨水要过量的原因是______________________________________________________。
(5)检验沉淀是否洗涤干净的方法是_________________________________________________。
(6)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量为W2 g,则样品中铁元素的质量分数是
______________________________。
20.(6分)(1)配置FeSO4溶液时,常加入一些 ,
目的是 。
(2)如何检验某FeSO4溶液已经变质?
。
19.(4分)钢铁在潮湿的空气中发生电化学腐蚀,请写出电极反应式,正极为: ;负极为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com