
题目列表(包括答案和解析)
18.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20oC |
23.3OC |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20OC |
23.5OC |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ.0C-1.Kg-1,各物质的密度均为1g.cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
17.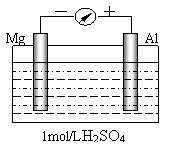 某研究性学习小组为了探究电解质溶液对电源电极的影响,设计了如下实验。以镁、铝为电极,稀H2SO4溶液为电解质溶液构成
某研究性学习小组为了探究电解质溶液对电源电极的影响,设计了如下实验。以镁、铝为电极,稀H2SO4溶液为电解质溶液构成
如图所示的原电池。实验时,铝片表面产生气泡
较多,镁条表面几乎没有气泡。
根据以上实验现象,回答下列问题:
(1)原电池的正极是______(填“Mg”或“Al”);
正极反应式是 。
(2)若以稀NaOH溶液为电解质溶液进行实验,发现铝片表面几乎没有气泡,镁条表面产生气泡较多。则原电池的负极是______(填“Mg”或“Al”);负极反应式是 ;
原电池总反应式为 。
16.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点和沸点逐渐升高
B.HF、HCl、HBr、HI的稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
 第Ⅰ卷(选择题 共48分)
第Ⅰ卷(选择题 共48分)
请将选择题答案填入下表:

第Ⅱ卷(非选择题 共72分)
15.已知短周期元素的离子aA2+、bB+、cC3-、dD- 含有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.元素的第一电离能:A>B>D>C
14.下列叙述中正确的是
A.P4和NO2都是共价化合物
B.CH4和NH4+为等电子体,它们的空间结构相同。
C.C60气化和I2升华克服的作用力相同
D.共价键的本质是电子云的重叠,而电子云都有一定的伸展方向,因此共价键都具有方向性。
13.下列说法不正确的是
A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。
B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。
12.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.12克金刚石中含有C-C键的数目为2NA。
B.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2
C.合成氨反应达平衡时,有2molNH3 分子生成同时就有3NA个H-H形成。
D.1molP4含有4NA个P-P键。
11.在相同温度下,用同体积同浓度的盐酸与足量的石灰石反应,并在一定的时间内
测量反应所放出的CO2的体积.实验I用的是块状的石灰石,实验Ⅱ用的是粉末状的
石灰石。下列图中能正确反应两种实验结果的是
A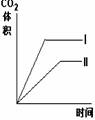 B
B C
C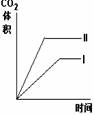 D
D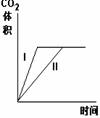
10.已知有下列热化学方程式:
Zn(s)+1/2O2(g)= ZnO(s); △H=-351.1KJ/mol ,
Hg(l)+ 1/2O2(g)= HgO(s) ; △H=-90.7KJ/mol,由此可知:
Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),在相同条件下的△H为
A.-441.8KJ/mol B.+260.4KJ/mol C.+441.8KJ/mol D.-260.4KJ/mol
9.下列事实不能用勒夏特列原理来解释的是
A.合成氨的反应中使用过量的N2
B.使用催化剂有利于合成氨的反应
C.高压有利于合成NH3的反应
D.500℃左右比室温更有利于合成NH3的生产
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com