
题目列表(包括答案和解析)
12.下列说法正确的是
A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B.在101kPa时,1molH2完全燃烧生成气态水,放出285.8kJ热量,H2燃烧热为285.8kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+ (aq) + OH-(aq) === H2O(l);△H= -57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
11.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
10.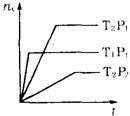 反应mA(气)+B(气)
反应mA(气)+B(气) nC(气)
nC(气) H=X,在不同温度(T1和T2)及压强(P1和P2)下,产物C的物质的量(nc)与反应时间(t)的关系如右图所示,下述判断正确的是
H=X,在不同温度(T1和T2)及压强(P1和P2)下,产物C的物质的量(nc)与反应时间(t)的关系如右图所示,下述判断正确的是
A.T1>T2,P1>P2,m≥n,X>0
B.T1>T2,P1>P2,m≥n,X<0
C.T1<T2,P1<P2,m≤n,X<0
D.T1>T2,P1<P2,m≤n,X>0
9.一定温度下, 向aL的密闭容器中加入2molNO2(气), 发生如下反应:
2NO2 2NO+O2,
此反应达到平衡的标志是
2NO+O2,
此反应达到平衡的标志是
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO和O2的物质的量之比为2:2:1
D.单位时间内生成2nmolNO同时生成2nmolNO2
24.在相同温度下,向a,b两密闭容器中均同时充入0.5molA和0.2molB的混合气体,起始体积均为2L,a容器保持容积不变,b容器中的活塞可上下移动,保持压强不变。发生反应3A(气)+B(气) 2C(气)+D(气)
;10min后a中达平衡,
生成物D的浓度为0.05mol.L-1, tmin后b中达平衡,生成物D的浓度为dmol.L-1。试回答下列问题:
2C(气)+D(气)
;10min后a中达平衡,
生成物D的浓度为0.05mol.L-1, tmin后b中达平衡,生成物D的浓度为dmol.L-1。试回答下列问题:
(1)a容器中前10min平均反应速率v(C)=
(2)比较大小:d 0.05(填>、<、=、或无法比较;下同);t 10;
(3)求平衡时a容器中B物质的转化率及该温度下反应的化学平衡常数K。
23.已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量, 1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1) CH4的热值为 。
(2) 若将CH4和CO的混合气体1 mol完全燃烧,生成 CO2气体和液态水时,
则放出热量(Q)的取值范围是 。
(3)若将CH4和CO的混合气体a mol完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)是: 。
22.右图中电极a、b分别为Ag电极和Pt电极,
电极c、d都是石墨电极。通电一段时间后,b电
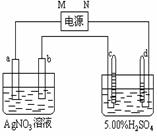 极质量增加,只有c、d两极上收集到气体。回答:
极质量增加,只有c、d两极上收集到气体。回答:
(1)直流电源中,M为 极;
电极a的反应式为 。
(2)电极b、c、d分别生成的物质的物质的量
之比为 _ __∶ ∶ 。
(3)AgNO3溶液的浓度 ( 填“增大”、“减小”或“不变”。下同 ),
H2SO4溶液的浓度 。

21.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排式为ns1,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
③Z元素的电离能数据见下表(kJ·mol-1):
请回答:
(1)Z 2Y中含有的化学键类型为 ,Z 2Y2的晶体类型为 。
(2)ZYX的电子式为 ,XWY的结构式为 ,X 2Y属于 (填“极性”或“非极性”)分子。
(3)晶体ZW的熔点比晶体XW的明显高的原因是
20.某离子晶体晶胞结构如下图所示,x位于立方体的
顶点,Y位于立方体中心。试分析:
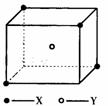 (1)晶体中每个Y同时吸引着__________个X,每
(1)晶体中每个Y同时吸引着__________个X,每
个x同时吸引着__________个Y,该晶体的化学式
为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等
的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角
∠XYX的度数为__________。

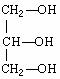
19.按要求完成下列问题:
(1)写出Mg2+的电子排布式和轨道表达式
; 。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3) 判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角
; ; 。
(4) 若Pt(NH3)2 Cl2分子是平面结构,请画出Pt(NH3)2 Cl2可能的结构简式
、
 (5)用 * 标出下列属于手性分子中含有的手性碳原子
(5)用 * 标出下列属于手性分子中含有的手性碳原子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com