
题目列表(包括答案和解析)
16.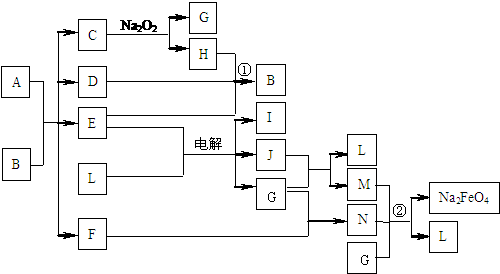 A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物。甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其化学式量分别为124、180。图中C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体;部分生成物没有列出。
A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物。甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其化学式量分别为124、180。图中C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体;部分生成物没有列出。
请填写以下空白:
(1)C的电子式为 ,甲和乙的化学式分别为 、 ;
(2)反应①的化学方程式 ;
电解E、L混合物的离子方程式 ;
(3)钢铁的表面发蓝、发黑处理是常用的防腐方法。6Na2FeO2+ NaNO2+ 5H2O = 6NaFeO2+ NH3↑+ 7NaOH是主要处理反应之一。而工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
15. DIS数字化信息系统因为可以准确测量溶液的pH而在中和滴定的研究中应用越来越广泛深入。某学习小组利用DIS系统探究强碱和不同酸的中和反应的过程如下:
实验步骤:
①.分别配制0.1mol/L的NaOH、HCl、CH3COOH、H3PO4溶液备用。
②.在锥形瓶中加入10mL0.1mol/L的HCl,在25.00mL碱式滴定管中加入0.1mol/L的NaOH,连接数据采集器和pH传感器。
③.向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④.存储计算机绘制的pH变化图。
用0.1mol/L的CH3COOH、H3PO4溶液代替HCl重复上述②-④。
⑤.结果分析。
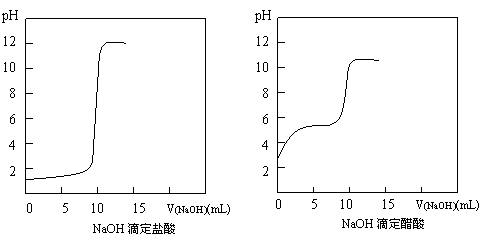 ⑴.NaOH滴定HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有:
⑴.NaOH滴定HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有:
①. ;
②. ;
③. ;
⑵.你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”),理由是 ;如果不可行,你建议的简易改进方法是 (如认为可行,此空不答)。
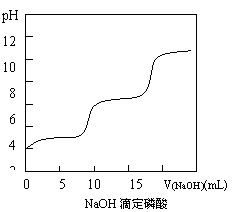 ⑶.右图是改进后的NaOH滴定磷酸的pH变化曲线图,已知曲线右端NaOH已过量。
⑶.右图是改进后的NaOH滴定磷酸的pH变化曲线图,已知曲线右端NaOH已过量。
①.该图与上述两图的不同点是:
;
②.写出磷酸的电离方程式:
;
③.你认为曲线中没有第三个突跃的可能原因是
。
14.在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A.平衡时,甲、乙两容器中A、B的物质的量之比不相等
B.若平衡时,甲、乙两容器中A的物质的量相等,则x=2
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为5∶8
13.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,不正确的是
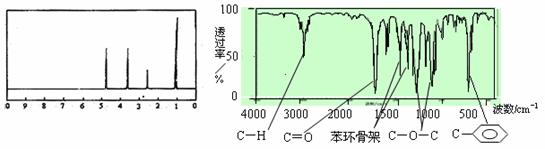
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
12.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由LiAlCl4溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li +3SOCl2==6LiCl +Li2SO3 +2S,下列有关叙述正确的是
A.金属锂作电池的正极,石墨作电池的负极
B.电池工作过程中,SOCl2被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4 :1
11.
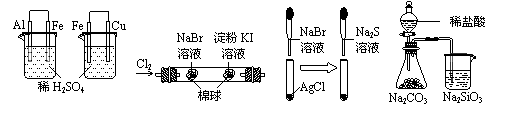 根据下列实验现象,所得结论正确的是
根据下列实验现象,所得结论正确的是
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解度:AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
10.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-
 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol·L―1的H2A溶液
② 0.01mol·L―1的NaHA溶液
③ 0.02mol·L―1的HCl溶液与0.04mol·L―1的NaHA溶液等体积混合
④ 0.02mol·L―1的NaOH溶液与0.02mol·L―1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是
 A.溶液②中存在水解平衡:HA-+H2O
H2A+OH-
A.溶液②中存在水解平衡:HA-+H2O
H2A+OH-
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)浓度大小:③>①>②>④
9.下列离子方程式书写正确的是
A.过氧化钠固体与水反应: 2O22-+2H2O == 4OH-+O2↑
B.NaHS溶液呈碱性:HS-+ H3O+ 
 H2S + H2O
H2S + H2O
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3++7SO42-+7Ba2++14OH-==2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O
D.稀HNO3中加入过量铁粉: Fe + NO3- + 4H+ == Fe3+ + NO↑+ 2H2O
8.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是
①用pH试纸测定Na 2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
A.②③⑦ B.③④⑤ C.⑤⑥⑦ D.④⑥⑦
7.已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘。在下列物质中,应加入的物质是
A.H2O B.Zn C.KI D.NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com