
题目列表(包括答案和解析)
4.某实验小组通过实验证明了海水中确实存在碘元素,并获得了一定量的碘水。现欲从碘水中进一步提取碘首先需要
A.萃取 B.沉淀 C.蒸馏 D.过滤
3.近20年来,同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.1H216O比1H218O的摩尔质量小
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
2.硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。下列物品用到硅单质的是
A.玻璃制品 B.石英钟表 C.计算机芯片 D.光导纤维
1. 2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔的主要贡献是研究气相物质与固相物质表面发生反应的化学原理,开创了表面化学的先河。以下问题或事实与表面化学无关的是
2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔的主要贡献是研究气相物质与固相物质表面发生反应的化学原理,开创了表面化学的先河。以下问题或事实与表面化学无关的是
A.铁在潮湿的空气中容易生锈的原理研究
B.铁作为催化剂采用氮气和氢气反应合成氨
C.CO与NO在催化剂存在时生成CO2和N2
D.CuSO4溶液中加入BaCl2溶液时产生白色沉淀
23.(9分)向10mL 0.1mol/L的AlCl3溶液中逐滴滴加NaOH溶液,当NaOH溶液体积为30mL时,生成最多沉淀。
(1)计算NaOH溶液物质的量浓度(此小题要求写出解题过程)。
(2)当溶液中所含的铝元素质量与沉淀中所含的铝元素质量相等时,所加NaOH溶液的体积为 。
22.(4分)某温度下在等容密闭容器中发生如下反应:2M(g)+N(g) 2E(g),
2E(g),
(1)若开始时只充入2mol E,达平衡时,混合气体的压强比起始时增大了20%;平衡时N的物质的量是 。
(2)若开始时只充入2molM和1molN的混合气体,达平衡时各物质浓度与(1)相同,M的转化率为 。
(1)0.4mol (2)60%
21.(14分)回答下面用0.1000mol/L NaOH溶液滴定待测硫酸溶液的问题:
(1)盛放待测硫酸的锥形瓶下方垫一张白张的作用是 。
(2)用酚酞作指示剂,滴定到达终点时,溶液颜色变化是 。
(3)滴定时,左手 ,右手 ,眼睛注视 。
(4)有下列操作:
①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准NaOH溶液
②用酸式滴定管取用待测液前,尖嘴部位有气泡,取用过程中气泡消失
③滴定前,读碱式滴定管内碱液体积时仰视液面,滴定后读碱液体积时,俯视液面
④锥形瓶未用待液润洗
哪些操作会使硫酸浓度的测定值偏低? 。
哪些操作会使硫酸浓度的测定值偏高? 。
 (5)若滴定到终点时不慎多滴了一滴NaOH溶液(假定20滴为1mL),此时溶液体积为50mL,则此时溶液的pH为
。
(5)若滴定到终点时不慎多滴了一滴NaOH溶液(假定20滴为1mL),此时溶液体积为50mL,则此时溶液的pH为
。
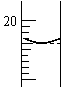
(6)若实验取待测液体积为20.00mL,碱式滴定管初读数为0.00mL,
达到终点时读数如图所示。则待测液物质的量浓度为 。
(1)便于观察溶液的颜色变化,减小滴下误差。
(2)由无色变为浅红色,并在半分钟内不褪色。
(3)控制滴定管(玻璃球);摇动锥形瓶;溶液颜色变化
(4)②③;① (5)10 (6)0.5100mol/L
20.(7分)泡沫灭火器的原理是将明矾溶液和NaHCO3溶液分别盛装在两个容器中(铁质容器和玻璃容器),使用时将两溶液混合,即可产生大量CO2气体和Al(OH)3沉淀。
(1)明矾溶液应盛装在 容器中,原因是 。
(2)明矾与NaHCO3溶液反应的离子方程式 。
(3)能否将NaHCO3溶液换成等体积等物质的量浓度的Na2CO3溶液: ,原因是 。
(1)玻璃容器; Al3+水解溶液成酸性,腐蚀铁质容器。
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
(3)不能; 等物质的量的CO32-消耗H+是HCO3-的两倍,明矾水解提供的H+不能使Na2CO3完全反应生成CO2,影响灭火效果。(要点:①等物质的量的Na2CO3耗H+比NaHCO3多,②Na2CO3不能完全反应生成CO2。)
19.(6分)(1)铝片和足量的氢氧化钠溶液反应,若铝片上连接镁条并一起浸入氢氧化钠溶液,化学反应速率 (填“增大”、“减小”、“不变”),产生H2的体积(相同状况) (填“增大”、“减小”、“不变”),负极上的电极反应方程式为 。
增大 不变 Al - 3e- = Al3+
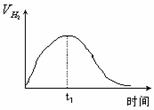 (2)右图为将Zn投入一定浓度一定体积的H2SO4中,解释
(2)右图为将Zn投入一定浓度一定体积的H2SO4中,解释
t1时刻前速率变化的原因是 ,t1时刻后速率变化的原因是 。(纵坐标为H2的生成速率)
开始时反应放热,溶液温度升高,反应速率加快;
到一定时间时盐酸浓度减小,反应速率减慢。
18.(9分)在保存FeCl2 溶液时,通常加入少量的铁粉或铁钉,目的是 。为了检验FeCl2溶液是否变质,可加入 ,现象是 。向FeCl2溶液中滴入NaOH溶液,现象是 ,有关化学方程式为 。
防止Fe2+被氧化 KSCN溶液 溶液变红色
产生白色沉淀,迅速变为灰绿色,最后变红褐色。
FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl 4NaOH + O2 + 2H2O = 4Fe(OH)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com