
题目列表(包括答案和解析)
4.下列说法不正确的是
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
3.下列说法不正确的是
A. 乙二醇和丙三醇为同系物
B.正戊烷、异戊烷、新戊烷的沸点逐渐降低
C.CH3-CH=CH2和CH2=CH2的最简式相同
D.CH≡CH和C6H6含碳量相同
2.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl
C.Cl2 D.F2
1.能用酸性高锰酸钾溶液鉴别的一组物质是
A.乙烯 乙炔
B.苯 己烷
C.己烷 环己烷
D.苯 甲苯
20.(10分)含氮(设氮元素都以NO3-的形式存在)废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
⑴现要除去含NO3-的物质的量浓度为3×10-4mol/L的废水,每吨废水至少需要消耗金属铝__________g(假设废水的密度为1g/cm3)。
⑵事实上,金属镁比铝能更快消除水体中氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_____________________________ 。
②目前国际现货市场每吨镁粉为1730美元左右,每吨铝粉的价格为3585美元左右,从价效比的角度出发,请通过计算分析应选用哪种金属清除水体中的氮元素经济上更合算?
19.(9分)将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后,测得容器内CO2的体积为1.12L(标准状况)。将反应后的固体残渣Y与过量的稀盐酸反应,生成3.36L(标准状况)的CO2。试回答:
⑴Y的主要成分是 (写化学式)。
⑵原混合物中NaOH的质量为 ;NaHCO3的质量为 。
18.(18分)下图是元素周期表中的前四周期。现有①-⑥六种元素,在元素周期表中的位置如图所示,试回答下列问题:
|
① |
|
|
|||||||||||||||
|
|
|
|
|
③ |
④ |
|
|
|
|||||||||
|
② |
|
|
|
|
|
⑤ |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
⑴上述六种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
⑵元素①和③可以形成众多的化合物,其中最简单的是 (写化学式),
该化合物中,化学键的类型为 。
⑶元素④的最高氧化物的水化物,其稀溶液能与Cu发生反应,反应中该稀溶液的作用是 。
⑷元素⑤的最外层电子数为 ;元素⑤和⑥相比,非金属性强的是 ,能说明该结论的化学事实为 (用离子方程式表示)。
17.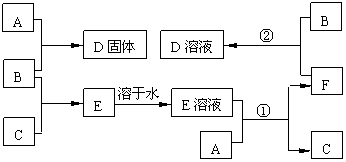 (11分)下列物质A-F是我们熟悉的单质或化合物,其中A是一种常见的金属单质,B、C为常见非金属单质。 E的水溶液呈无色,能使紫色的石蕊试液变红色,加入AgNO3溶液生成不溶于稀硝酸的白色沉淀。在适当的条件下,它们可以按下面框图进行反应。
(11分)下列物质A-F是我们熟悉的单质或化合物,其中A是一种常见的金属单质,B、C为常见非金属单质。 E的水溶液呈无色,能使紫色的石蕊试液变红色,加入AgNO3溶液生成不溶于稀硝酸的白色沉淀。在适当的条件下,它们可以按下面框图进行反应。
试回答下列问题:
⑴B的电子式是____________,C的分子式是__________;E属于__________(选填“离子”或“共价”)化合物。
⑵反应②的离子方程式是_____________________________。
⑶鉴别D和F两种物质水溶液的方法是 。
16.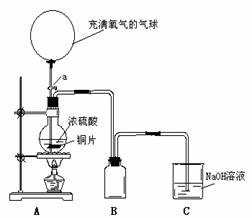 (14分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置并进行有关实验。
(14分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置并进行有关实验。
请回答下列问题:
⑴ 先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有少量铜片剩余。
①写出上述过程中烧瓶内发生的化学方程式:
。
②B是用来收集实验中产生的气体的装置,但导 管未画全,请直接在原图上把导管补充完整。
③装置C的作用是 。
⑵ 事实表明,上述反应全部结束后,硫酸仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。写出发生反应的总的离子方程式 。
⑶反应全部结束后,为充分利用药品,该小组同学取烧瓶中的少量溶液于烧杯中,加水稀释后,再加入金属钠继续进行实验。意外地发现生成的蓝色沉淀中混有少量黑色沉淀。你认为该黑色难溶物是 ,生成该黑色难溶物的可能原因是
。
15.(10分)现用18.4mol/L的浓硫酸配制500mL0.2mol/L的稀硫酸。可供选用的仪器有:
① 玻璃棒 ②量筒 ③ 烧杯 ④ 胶头滴管
请回答下列问题:
⑴ 配制稀硫酸时,还缺少的仪器有 (填写仪器名称)。
⑵ 经计算,配制500mL0.2mol/L的稀硫酸需要上述浓硫酸的体积为 ,量取浓硫酸时应选用 (选填 ① 10mL、② 50mL 、③ 100mL)规格的量筒。
⑶稀释浓硫酸时,应如何操作? 。
⑷ 某同学定容时,加水超过容量瓶的刻度线,再用胶头滴管吸去,则所配制的稀硫酸物质的量浓度 (填写“偏大”、“偏小”或“ 不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com