
题目列表(包括答案和解析)
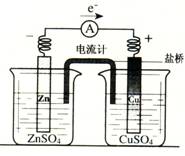
8. 有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是 A.反应中,盐桥中的K+会移向ZnSO4溶液 B.工作时,电流计指针偏向铜片 C.取出盐桥后,电流计依然发生偏转 D.反应前后铜片质量不改变
7.
 右图
右图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,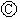 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色。为实现铁上镀锌,接通
上的c点显红色。为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
6.
 若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是
Cu + 2H+ ===Cu2+ + H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池,但电解质溶液必须是酸溶液
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是原电池,且正极不能用锌、铁等比铜活泼的金属
D.该装置只能是电解池,且金属铜为该电解池的阳极
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是
Cu + 2H+ ===Cu2+ + H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池,但电解质溶液必须是酸溶液
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是原电池,且正极不能用锌、铁等比铜活泼的金属
D.该装置只能是电解池,且金属铜为该电解池的阳极
5. 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①
Sn(s、白) + 2HCl(aq)=
SnCl2(aq) + H2(g) △H 1
②
Sn(s、灰) + 2HCl(aq)=
SnCl2(aq)+ H2(g) △H 2
③Sn(s、灰)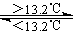 Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A.△H1 >△H2 B.灰锡转化为白锡的反应是放热反应
C.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D.锡在常温下以灰锡状态存在
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A.△H1 >△H2 B.灰锡转化为白锡的反应是放热反应
C.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D.锡在常温下以灰锡状态存在
4. 强酸和强碱在稀溶液中的中和热可表示为: H+(aq)+OH-(aq)=H2O(l); △H=-57.3 kJ·mol-1,又知在溶液中反应有: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ·mol-1, 1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ;△H=-Q2 kJ·mol-1 HNO3(aq)+KOH(aq)= KNO3(aq)+H2O(l);△H=-Q3 kJ·mol-1 则Q1、Q2、Q3的关系正确的是 A.Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 C.Q2 > Q3 > Q1 D.Q2 = Q3 > Q1
3. 下列热化学方程式中的反应热表示燃烧热的是
A.C6H12O6(s)+6O2(g)
6CO2(g)+6H2O(l);△H=- akJ·mol-1
B.CH3CH2OH(l)+1/2 O2(g)
CH3CHO(l)+H2O(l);△H=-bkJ·mol-1
C.2CO(g)+ O2(g) 2 CO2(g);△H=-c kJ·mol-1
D.NH3(g)+ 5/4O2(g) NO(g)+
3/2H2O(g);△H=-d kJ·mol-1
2. 1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为 A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol C.-(10X-Y) kJ/mol D.+(10X-Y) kJ/mol
1. 在同温同压下,下列各组热化学方程式中,△H1<△H2的是 A.2H2(g) + O2(g)=2H2O(g);△H1 2H2(g) + O2(g) = 2H2O(l);△H2 B.S(g) + O2(g) =SO2(g); △H1 S(s) + O2(g) = SO2(g);△H2 C.CO(g) + 1/2 O2(g) =CO2(g);△H1 C(g) + O2(g) = CO2(g);△H2 D.1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H1 H2(g) +Cl2(g)=2HCl(g);△H2
2. 请将全部答案填到答题卷中。
可能用到的相对原子质量: H 1 C 12 O 16 S 32 K 39 Fe 56 Cu 64 Zn 65
第Ⅰ卷 (选择题 共42分)
在下列各题的四个选项中均只有一个是符合题目要求的。
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间90分钟。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com