
题目列表(包括答案和解析)
28.
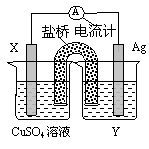 (5分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
设计的原电池如下左图所示。请回答下列问题:
(1)电极X的材料是
;电解质溶液Y是
;
(2)银电极为电池的
极;X电极上发生的电极反应为
;
(3)盐桥中的阳离子移动的方向是
。
(5分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
设计的原电池如下左图所示。请回答下列问题:
(1)电极X的材料是
;电解质溶液Y是
;
(2)银电极为电池的
极;X电极上发生的电极反应为
;
(3)盐桥中的阳离子移动的方向是
。
27.
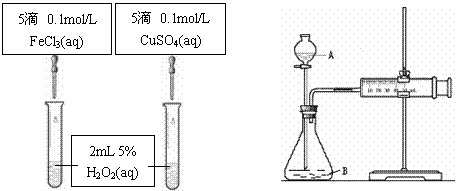 (5分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图A、图B所示的实验。
(1)图A可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是
,你认为还可以作何改进?
。
图A
图B
(2)检查图B装置气密性的方法是
。
图B所示实验中需测量的数据是
。
(5分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图A、图B所示的实验。
(1)图A可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是
,你认为还可以作何改进?
。
图A
图B
(2)检查图B装置气密性的方法是
。
图B所示实验中需测量的数据是
。
26.
(11分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
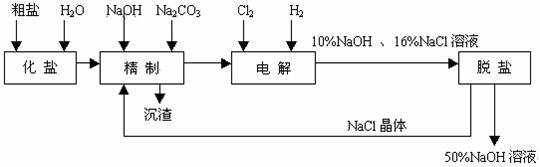 依据上图,完成下列填空:
(1) 在电解过程中,与电源正极相连的电极上所发生反应的化学方程式(电极反应式)为
,与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,该试剂可以是 。
a. Ba(OH)2 b. Ba(NO3)2 C. BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (填a,b,c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 、(填操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
依据上图,完成下列填空:
(1) 在电解过程中,与电源正极相连的电极上所发生反应的化学方程式(电极反应式)为
,与电源负极相连的电极附近,溶液pH值 (选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,该试剂可以是 。
a. Ba(OH)2 b. Ba(NO3)2 C. BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (填a,b,c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 、(填操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
25.
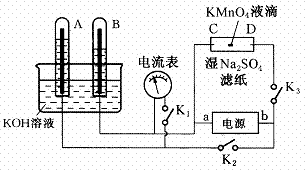 (8分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2、K3通直流电,回答下列问题:
(1)判断电源的正、负极:
a为________极,b为________极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象
________ 。
(3)写出电极反应式:
A极____
____,
C极______ _______。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否)
________。说明理由____________________________。
(8分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2、K3通直流电,回答下列问题:
(1)判断电源的正、负极:
a为________极,b为________极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象
________ 。
(3)写出电极反应式:
A极____
____,
C极______ _______。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否)
________。说明理由____________________________。
24. (2分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。 (2)(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1 Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1 写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: _________________ 。
23. (3分)某反应aA(g)+ b B(g) 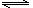 cC(g)+d
D(g),取a molA和b molB置于V L容器中,t min后,测得容器内A的浓度为x mo1·L-1,这时B的浓度为
mo1·L-1, C的浓度为
mo1·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示应为
。
cC(g)+d
D(g),取a molA和b molB置于V L容器中,t min后,测得容器内A的浓度为x mo1·L-1,这时B的浓度为
mo1·L-1, C的浓度为
mo1·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示应为
。
22.
(3分)对于反应:C(s)+H2O(g)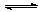 H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列哪些条件能加快正反应速率的是
。
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列哪些条件能加快正反应速率的是
。
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
21. 下列关于铜电极的叙述,正确的是 A.铜锌原电池中铜为负极,发生氧化反应 B.在镀件上电镀铜时,可用精铜作阳极 C.用电解法精炼粗铜时,粗铜作阴极 D.电解稀H2SO4制H2、O2时,用铜作阳极
第Ⅱ卷 (非选择题 共58分)
20. 以下反应不可以用熵判据来解释的是 A.硝酸铵自发地溶于水 B.CaCO3(s) == CaO(s)+CO2(g) △H=+175.7kJ/mol C.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol D.2H2(g)+O2(g)==2H2O(l) △H=-285.8kJ/mol
19. 下列反应中生成物总能量低于反应物总能量的是 A.Ba(OH)2·8H2O+2 NH4Cl===BaCl2+ 2NH3+10H2O B.高锰酸钾分解 C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com