
题目列表(包括答案和解析)
18.(10分)实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液
⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
|
实验方案 (只填写选用试剂序号) |
实验现象 |
结论 |
|
|
⑴ |
|
一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 |
金属性: |
|
⑵ |
|
|
非金属性:Cl>Br |
写出实验(2)中所发生的离子反应方程式
17. (10分)按要求完成下列各小题:
(10分)按要求完成下列各小题:
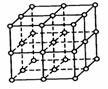
⑴如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑休积的大小)。请将其中代表Na+的圆圈涂黑,以完成NaCl晶体的结构示意图。
⑵干冰晶体中,每个CO2所处的位置与NaCl晶体中Na+或Cl-的位置相同。干冰晶体中,在每个CO2分子的周围与它最接近的且距离相等的CO2分子共有__________个。
⑶碳化硅(SiC)是一种具有类似金刚石结构的晶体,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是_______(填序号)。
⑷C60固体与金刚石熔点更高的是________,原因是____________________ __________。
16.(6分)某元素的激发态原子的电子排布式为1s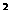 2s
2s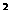 2p
2p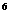 3s
3s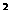 3p
3p 4s
4s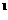 ,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是 。
,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是 。
15.(6分)现有下列物质, 用编号填空回答下列各问:
A.干冰 B.金刚石 C. 氩 D.晶体硅 E.过氧化钠 F.二氧化硅G. 氯化铵
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)属于分子晶体,且分子为直线型结构的是 。
(4)由原子构成的分子晶体是 。
(5)含有非极性键的离子化合物是 。
(6)含有离子键、共价键、配位键的化合物是 。
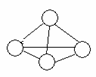
14.白磷分子如右图所示,则31g白磷分子中存在的共价键数目是:
(NA表示阿佛加德罗常数的值)P-31
A.4NA B.NA C.1.5NA D.0.25NA
第Ⅱ卷(非选择题,共72分)
13.下列各组中的X和Y两种原子,化学性质一定相似的是
A.X原子和Y原子最外层都只有一个电子
B.X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
 D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
12.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是
A.X:3s23P1 Y:3s23P5 B.X:2s22P3 Y:2s22P4
C.X:3s23P1 Y:3s23P4 D.X:3s2 Y:2s22P3
11.关于晶体的下列说法正确的是:
A.任何晶体中,若含有阳离子就一定有阴离子。
B.原子晶体中只含有共价键。
C.原子晶体的熔点一定比金属晶体的高。
D.离子晶体中只含有离子键,不含有共价键。
10.下列说法不正确的是
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键
C. I2易溶于CCl4可以用相似相溶原理解释
D. 甲烷可与水形成氢键这种化学键
9.1919年,Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征。下列各对粒子中,空间结构相似的是
A.CS2与NO2 B.CO2与N2O C.SO2与O3 D.PCl3与BF3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com