
题目列表(包括答案和解析)
1. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是 A.第一电离能Y一定小于X B.气态氢化物的稳定性:HmX强于HmY C.最高价含氧酸的酸性:X对应的酸性强于Y的 D.X、Y形成化合物时,X显负价,Y显正价
2. 请将全部答案填到答题卷中。
可能用到的相对原子质量: H 1 C 12 O 16 S 32 Fe 56 Cu 64 Zn 65
第Ⅰ卷 (选择题 共66分)
在下列各题的四个选项中均只有一个是符合题目要求的。
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间90分钟。
29.(8分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:

 N2(g)+3 H2 (g) 2NH3 (g); △H=-92.4
kJ/mol 。
N2(g)+3 H2 (g) 2NH3 (g); △H=-92.4
kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。
试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 。

27.(12分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:
⑴上述关系一定不正确的是 (填序号)
⑵若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为(填序号) .
⑶若关系③正确,则溶液中溶质为 。
⑷若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
⑸25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填“>”、“<”、“=”、“无法确定”)
26.(
8分)某二元酸H2A的电离方程式是:H2A
= H++HA-,HA-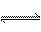 A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)Na2A溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(2)NaHA溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)若0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可
能 0.11mol·L-1(填“<”、“>”或“=”),理由是: ;
(4)0.1mol·L-1NaHA溶液中各离子浓度由大到小的顺序是 。
25.(12分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 。
 (2)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)
CO2(g)+H2(g)
(2)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
|
时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
C1 |
|
6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4-5min之间,改变的条件是 ,第5-6min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。
③397℃时该反应的平衡常数为12,请判断该反应的△H 0 (填“>”、“=”、“<”).
24. (4分)A、B两容器由极易导热的材料做成。A的容
(4分)A、B两容器由极易导热的材料做成。A的容
积不变,B容器有一活塞可以上下移动,保持内外压强相
等。在相同条件下,将等量NO2压入容积相同的A、B两
容器中发生反应:2NO2
 N2O4,ΔH<0 ,回答下列问
N2O4,ΔH<0 ,回答下列问
题(填>,=,<)
(1)反应刚开始时,生成N2O4的速度 vA vB;
(2)反应中生成N2O4的速度vA vB;
(3)平衡时两容器中分子总数NA NB;
(4)达到平衡时两容器的压强PA PB.
23.在一容积恒定的容器中充入2molA和1molB反应:2A(g)+B(g) XC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则X的值为
XC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则X的值为
A、2 B、3 C、可能为2,也可能为3 D、无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com