
题目列表(包括答案和解析)
1.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0
B.9.5
C.10.5
D.11.5
30. (12分)CuCl2溶液中含有少量杂质FeCl2,为制备纯净的晶体CuCl2·2H2O,拟定实验步骤如下:
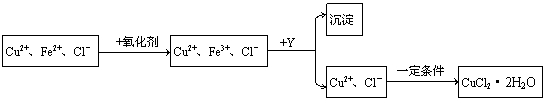

下面的数据可能对你解答本题有帮助。
已知:溶度积:Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)2]= 8.0×10-16 Ksp[Fe(OH)3]= 4.0×10-38
(1)第一步将Fe2+氧化为Fe3+最适宜的氧化剂是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入Y调节溶液的酸度的目的是使Fe3+沉淀完全,Y可选用下列物质中的 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
E.Cu2(OH)2CO3 F.Cu
(3)当溶液中c(Fe3+)<1.0×10-5mol/L时可以认为沉淀完全。试通过计算说明加入Y将溶液的pH调节至4.0能否使Fe3+沉淀完全?此时所得沉淀中是否有Cu(OH)2[假定溶液中c(Cu2+)=2.0mol/L]?
(4)从Fe3+沉淀完全后的溶液中获得CuCl2·2H2O晶体时应控制的一定条件是 。
29.


 Ⅰ(6分)右图分别是温度计、量筒、滴定管的一部分,
则:量筒应该是 读数为
mL;
Ⅰ(6分)右图分别是温度计、量筒、滴定管的一部分,
则:量筒应该是 读数为
mL;
滴定管应该是 ,读数为 mL;
温度计应该是 ,读数是 ℃。
Ⅱ(15分)在25.0mL 0.100mol·L-1盐酸中滴入0.200mol·L-1 NaOH溶液,以酚酞为指示剂。 (1)填写下表中所有空格:(计算结果保留一位小数)
|
加入NaOH溶液的体积(mL) |
5.0 |
7.5 |
10.7 |
12.0 |
12.3 |
a |
12.8 |
13.0 |
b |
17.5 |
20.0 |
|
溶液pH |
1.3 |
1.5 |
2.0 |
2.6 |
3.0 |
7.0 |
11.2 |
11.4 |
12.0 |
12.4 |
12.5 |
|
指示剂的颜色 |
无 |
无 |
无 |
无 |
无 |
无 |
红 |
红 |
红 |
红 |
红 |
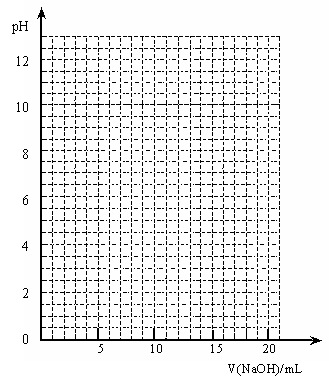
a = mL、b= mL
(2)根据上表中的数据,在右图格纸中,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图(坐标中pH变化及体积变化要标明),并中图标出水电离出的OH-浓度最大的点x。
(3)配制本实验所用的稀盐酸应选用的容量瓶规格为 (填字母)
A.25mL B.50 mL
C.100 mL D.250 mL
(4)除容量瓶外本实验必不可少的玻璃仪器是 ___________________ _ _ ____。
(5)进行中和滴定操作时,眼睛注视 __ _ ;
滴定终点的判断依据是 __________________ _____ _________。
28. (6分)已知0.1mol·L-1 CH3COONa溶液pH=8 (1)按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) 。 (2)精确表达下列算式的数学结果 ①C(Na+)-C(CH3COO-)= ;②C(OH-)-C(CH3COOH)= 。
27.
(8分)某溶液由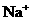 、
、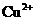 、
、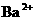 、
、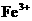 、
、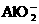 、
、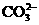 、
、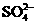 、
、 中的若干种离子组成。取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氨水,产生白色沉淀,过滤;
③在②所得滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④在③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是________________;一定存在的离子是________________。(2)写出步骤①有关反应的离子方程式___________________________________________。
中的若干种离子组成。取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氨水,产生白色沉淀,过滤;
③在②所得滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④在③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是________________;一定存在的离子是________________。(2)写出步骤①有关反应的离子方程式___________________________________________。
26. (15分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
|
最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)上述元素中属于同一主族且在s区的是 (填编号);元素④在周期表中的位置 ;元素⑨的氢化物的电子式为 ;元素⑤的价电子排布为 。
(2)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填编号);第一电离能最大的是 (填编号);不成对电子数最多的是 。
(3)元素③⑧能形成两种化合物,其中一种可以作为供氧剂,用化学方程式表明其供氧原理 。
(4)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。
(5)某元素R的原子半径为1.02×10-10m,该元素最高价氧化物的水化物化学式为 ;元素R与元素③相比,非金属性较强的是 (填编号),请写出可以验证该结论的一个化学反应的方程式 。
25. (8分)A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的轨道表示式是 ;D元素原子的外围电子排布式是 ;A2B2的电子式是 。
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
24. (8分)元素周期表是学习化学的重要工具之一,掌握其结构和递变规律是运用周期表的前提。请按要求回答下列各题: (1)写出下列各周期或族所包含的元素种数:第3周期____,第6周期_____,I A族____。 (2)已知A、B分别是第五周期的ⅢA族、ⅡA族元素,原子序数分别为m和n,则n-m的值_________。 (3)有X、Y、Z三种短周期表元素,在周期表中的相对位置如右图所示,X元素在周期表中 区;Y下面与Y相邻的元素的核电荷数为 ;写出Z元素最高价氧化物水化物的电离方程式 。
23.
(6分)判断下列电子排布式或轨道表示式是否正确,若不正确请说明违背了什么原理或规则:
(1)C原子的轨道表示式: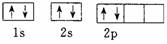 答:
。
(2)Ca原子的电子排布式:1s22s22p63s23p63d2 答:
。
(3)N原子的轨道表示式:
答:
。
(2)Ca原子的电子排布式:1s22s22p63s23p63d2 答:
。
(3)N原子的轨道表示式: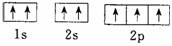 答:
。
(4)Fe2+的电子排布式:1s22s22p63s23p63d6
答:
。
(5)S原子的电子排布式:1s22s22p63s33p3 答:
。
(6)24Cr的电子排布式:[Ar] 3d44s2 答:
。
答:
。
(4)Fe2+的电子排布式:1s22s22p63s23p63d6
答:
。
(5)S原子的电子排布式:1s22s22p63s33p3 答:
。
(6)24Cr的电子排布式:[Ar] 3d44s2 答:
。
|
|
|
|
|
X |
|
Z |
|
|
|
|
|
|
Y |
|
|
|
|
|
? |
|
|
|
22.
下列操作中,能使电离平衡 H2O  H++OH– 向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
H++OH– 向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
第Ⅱ卷 (非选择题 共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com