
题目列表(包括答案和解析)
7、往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g) 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
 A.容器内气体颜色变深,平均相对分子质量不变
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
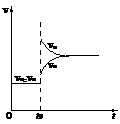
D.改变条件前后,速率图象为(如右图)
6、对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
5、本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
4、在密闭容器中,对于反应: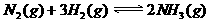 ,在反应起始时
,在反应起始时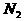 和
和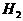 分别为10mol和30mol,当达到平衡时,
分别为10mol和30mol,当达到平衡时,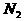 的转化率为30%。. 若以
的转化率为30%。. 若以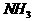 为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则
为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则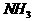 的起始物质的量和它的转化率,正确的是
的起始物质的量和它的转化率,正确的是
A. 40mol;35% B. 20mol;30% C. 20mol;70% D. 10mol;50%
3、相同条件下,通过相同的电量分别电解CuCl2和AgNO3,当生成1mol Cu时,则析出Ag的质量是
高一化学试题 (共8页) 第1页
A、108g B、54g C、216g D、64g
1、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H= -57.3KJ·mol-1 分别向1L0.5mol/L的NaOH溶液中加入:①稀醋酸②浓硫酸 ③稀硝酸,恰好完全反应的△H的绝对值分别为
△H1 △H2 △H3,它们的关系正确的是
A、 △H1>△H2>△H 3 B、 △H2<△H1<△H3
C、 △H1=△H2=△H3 D、 △H2>△H3>△H1
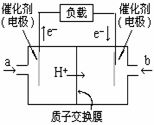 ( )2、如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
( )2、如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是
A.右边的电极为电池的负极,b处通入的是空气
B.右边的电极为电池的负极,b处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
25.氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,与0.100 mol / L HCl标准溶液反应,完全反应共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为
2007-2008学年新课标苏教版高中化学选修期末综合试题
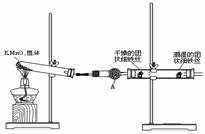
24.(16分)实验室用下列方法测定某水样中O2的含量。
 (1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
。
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
② 用注射器抽取20.00 mL 某水样从A 处注人锥形瓶。
③ 再分别从A 处注入含m molNaOH的溶液及过量的MnSO4 溶液。
④ 完成上述操作后,下面应进行的操作是 。
c是长橡胶管,使用较长橡胶管的目的是 。
(2)用I- 将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+
==Mn2++I2+3H2O。实验步骤:
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥ 重复④ 的操作。
(3)用Na2S2O3 标准溶液滴定步骤(2)中生成的I2,反应方程式为:
I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦ 取下锥形瓶,向其中加入2-3滴 作指示剂。
 ⑧ 用0.005 mol · L-1Na2S2O3 滴定至终点。
⑧ 用0.005 mol · L-1Na2S2O3 滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨ 经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩ 本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
23. (14分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
(14分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
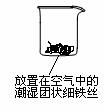
首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于______________。能表示其原理的反应方程式为__________________________________________________。
(2)仪器A的名称为__________,其中装的药品可以是__________,其作用是_________。
(3)由实验可知,该类铁生锈的条件为__________________________________________。
决定铁生锈快慢的一个重要因素是______________________________________________。
22.(8分)“碘钟”实验中,3I-+ S2O32- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O32-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.120 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22s B.22-44s C.>44s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com