
题目列表(包括答案和解析)
22、(7分)从H+、Na+、Cu2+、Cl-、SO42-五种离子中恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则采用的电解质为 。
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则采用的电解质为 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量减少,进行电解,采用的电解质为 。
19、催化剂之所以能加快反应速率,是因为
A.减小了反应速率常数 B.降低了反应的活化能
C.降低了反应的焓 D.降低了反应的熵
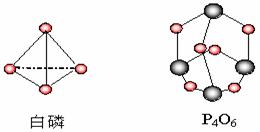 ( )20、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ•mol-1):
( )20、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ•mol-1):
P-P:198, P-O:360;
O==O:498。则反应:
P4(白磷)+ 3O2(g)=P4O6(s)的反应热△H为
A.-126 kJ•mol-1 B.+1638 kJ•mol-1 C.-1638 kJ•mol-1 D.+126 kJ•mol-1
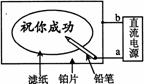 ( )21、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )21、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A 铅笔端作阳极,发生还原反应 B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生 D a点是负极,b点是正极
高一化学试题 (共8页) 第5页
高二化学试题
第Ⅱ卷(非选择题,共37分)
|
题 号 |
二 |
三 |
不规范 扣 分 |
总分 |
|||
|
22 |
23 |
24 |
25 |
26 |
|||
|
得 分 |
|
|
|
|
|
|
|

18、某化学反应其△H= -122 kJ·mol-1,∆S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
17、已知1×105Pa298K在条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A 、H2O(g)=H2(g)+1/2O2(g)△H=242KJ·mol-1
B 、2H2(g)+O2= 2H2O(l) △H=-484KJ·mol-1
C 、H2(g)+ 1/2O2= H2O(g) △H=242KJ·mol-1
D、2 H2(g) +O2= H2O(g) △H=484KJ·mol-1
16、反应2A(g)  2B(g)+E(g),正反应为吸热反应,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g),正反应为吸热反应,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减少E的浓度 D.降温
高一化学试题 (共8页) 第4页
13、某反应过程中体系的能量变化如图所示,下列说法错误的是
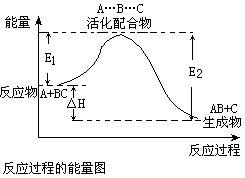 A、反应过程可表示为
A、反应过程可表示为
A+BC-→[A…B…C] -→AB+C
(反应物)(过渡态) (产物)
B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C、正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D、此图中逆反应的热效应△H=E1-E2,为吸热反应
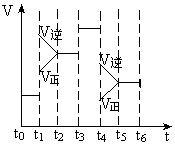 ( )14、反应N2(g)+3H2(g)
( )14、反应N2(g)+3H2(g) 2NH3(g),△H<0,在某一时间段中反应速率与反应过程的曲线关系如图,则氨的百分含量最高的一段时间是
2NH3(g),△H<0,在某一时间段中反应速率与反应过程的曲线关系如图,则氨的百分含量最高的一段时间是
A、t0-t1 B、t2-t3
C、t3-t4 D、t5-t6
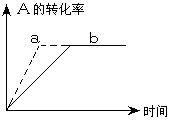 ( )15、已知某可逆反应在密闭容器中进行,A(g)+2B(g)
( )15、已知某可逆反应在密闭容器中进行,A(g)+2B(g) 3C(g)+D(s)(放热反应),曲线b代表一定条件下该反应的过程,若使曲线b为曲线a,可采取的措施是
3C(g)+D(s)(放热反应),曲线b代表一定条件下该反应的过程,若使曲线b为曲线a,可采取的措施是
A、增大A的浓度 B、缩小容器的体积
C、增大B的浓度 D、升高温度
11、将下列四组溶液在烧杯中分别同时迅速混合,此时,硫代硫酸钠和盐酸缓慢的进行反应,则出现浑浊的先后顺序是
①20℃时,10ml5.4mol·L-1的Na2S2O3溶液和20ml1.5 mol·L-1的盐酸
②20℃时,10ml4.0 mol·L-1的Na2S2O3溶液和10ml2.0 mol·L-1的盐酸
③30℃时,15ml3.5 mol·L-1的Na2S2O3溶液和10ml2.5 mol·L-1的盐酸
④30℃时,20ml3.0 mol·L-1的Na2S2O3溶液和10ml3.0 mol·L-1的盐酸
A、③④②① B、④③②① C、①②③④ D、④①③②
高一化学试题 (共8页) 第3页
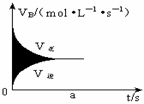 ( )12、如图,在容积固定的密闭容器中发生可逆反应A(g)+2B(g)
( )12、如图,在容积固定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g),则图中阴影部分的面积可表示为
2C(g),则图中阴影部分的面积可表示为
A、 t时间内消耗B的物质的量 B、t时间内生成C的物质的量
C、t时间内消耗B的物质的量浓度 D、t时间内消耗A的物质的量浓度
10、化学反应4A(s)+3B(g)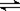 2C(g)+D(g),经过2minB的浓度减小0.6
mol/L.。此反应速率的表示正确的是
2C(g)+D(g),经过2minB的浓度减小0.6
mol/L.。此反应速率的表示正确的是
A、用A表示的反应速率是0.4mol/L·min-1
B、分别用B、C、D表示的化学反应速率,其比值是3:2:1
C、在2 min末的反应速率,用B表示是0.3mol/L·min-1
D、在2 min内用B和C表示的反应速率的值都是逐渐减少的。
9、向固定容积为1L的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)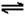 3C(g)+D(s),达到平衡时,C的浓度为1.2
mol·L-1。若维持容器的体积和温度不变,按下列方式改变起始物质及其物质的量,则达到平衡时,C的浓度为2.4
mol·L-1的是
3C(g)+D(s),达到平衡时,C的浓度为1.2
mol·L-1。若维持容器的体积和温度不变,按下列方式改变起始物质及其物质的量,则达到平衡时,C的浓度为2.4
mol·L-1的是
A、4molA+2molB+1molC B、3molC+1molD+1molB
C、6molC+2.5molD D、1.6molA+0.8molB+0.6molC+0.3molD
8、在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下
高一化学试题 (共8页) 第2页
发生反应建立的化学平衡:aA(g) + bB(g)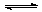 xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
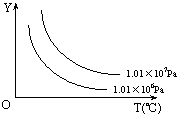
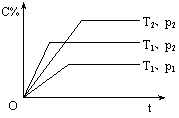
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com