
题目列表(包括答案和解析)
6、下列事实与氢键有关的是( )
①NH3易液化;②氧族元素的氢化物中,H2O的沸点最高;③卤族元素的氢化物中,HF的稳定性最强;④冰的密度比水小;⑤H2S的还原性强于H2O
A、①②③ B、①②④ C、①②③④ D、全部
5、下列叙述正确的是( )
A、原子晶体都是单质,晶体中只含有共价键
B、离子晶体都是化合物,晶体中只含有离子键,不含有共价键
C、分子晶体既有单质又有化合物,晶体中只存在分子间作用力,不含有其他化学键
D、金属晶体都是单质,晶体中含有阳离子,但不含有阴离子
4、下列各组物质中,化学键类型相同,晶体类型也相同的是( )
A、C(金刚石)和CO2 B、NaBr和HBr
C、CH4和H2O D、Na2O2和H2O2
3、下列高分子材料与其用途对应关系不正确的是( )
|
|
材料 |
用途 |
|
A |
聚乙烯 |
食品袋、包装袋 |
|
B |
合成橡胶 |
橡皮管、轮胎 |
|
C |
硅聚合物、聚氨酯 |
人工心脏等人造器官 |
|
D |
玻璃钢 |
高强度导电材料 |
2、2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷。已知丙烷的燃烧热为 2221.5 KJ/mol,下列有关说法不正确的是( )
A、丙烷的沸点比正丁烷低
B、奥运火炬燃烧主要是将化学能转变为热能和光能
C、丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D、丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)====3CO2(g)+4H2O(1);
 2 221.5 kJ/mol
2 221.5 kJ/mol
1、下列叙述,从化学角度分析正确的是( )
A、木材、棉花、羊毛、尼龙都属于天然纤维,而锦纶、碳纤维、光导纤维则属于合成纤维
B、煤气化技术的使用,虽然能达到减少二氧化硫和烟尘排放的目的,但不能提高煤的燃烧效率
C、食用植物油的主要成分是高级饱和脂肪酸甘油酯,是人体的营养物质
D、改进塑料的配方和生产工艺,研究开发易分解的新型塑料,如淀粉塑料、水溶塑料、光解塑料等是治理“白色污染”的发展方向
26、(6分)在温度为373K时,把11.5g N2O4气体通入体积为500ml的真空密闭容器中立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
⑴开始时2s内以c(N2O4)的变化表示的反应速率是多少?
⑵达到平衡时体系内的压强是开始的多少倍?
高一化学试题 (共8页) 第8页
25、(6分)向一定压的仪器中充入4LN2和H2的混合气体,反应后恢复到原温度, 体积变为3.4L,容器内气体对相同条件下H2的相对密度为5。
⑴反应达到平衡时V(NH3)= L,
反应前V(N2):V(H2)= ,N2的转化率为 。
⑵向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量。
①从开始到重新平衡,混合气体对H2的相对密度变化为 ;
A、先增大后变小 B、先减小后增大 C、一直减小 D、一直不变
②写出合成氨的热化学方程式:
24、(11分)实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪器名为______________________。
(2)两只烧杯间要填满碎纸条,其目的是________________________;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将____________(填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C =4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=________________。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量______________(填“相等”“不相等”),所求中和热______________(填“相等”“不相等”),简述理由__________________________________________________________________________________________________________________________
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会__________;若改用50mL 0.50 mol/L烧碱溶液进行上述实验,测得的中和热的数值会______________。(填“偏大”、“偏小”、“无影响”)
高一化学试题 (共8页) 第7页
23、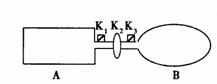 (7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2
(7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率
αA将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡
高一化学试题 (共8页) 第6页
时,A中NO2的转化率将_________,B中NO2的转化率将_________(填:
变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com