
题目列表(包括答案和解析)
3.下列实验的方法正确的是
①除去乙烷中少量的乙烯:在催化剂加热条件下通入氢气
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
③检验甲酸中是否含有甲醛:加足量NaOH溶液,蒸馏;馏出液中加银氨溶液并水浴加热。
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
 A. ①② B.① ②④ C. ①③④ D. ②③④
A. ①② B.① ②④ C. ①③④ D. ②③④
1.(2007年高考广东卷)下列关于有机化合物的说法正确的是
A. 乙醇和乙酸都存在碳氧双键 B. 甲烷和乙烯都可以与氯气反应
C. 高锰酸钾可以氧化苯和甲烷 D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
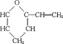
2(2006年高考上海化学卷)下列有机物命名正确的是
 A. 2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
A. 2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
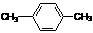 C. 间二甲苯 D.
C. 间二甲苯 D.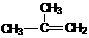 2-甲基-2-丙烯
2-甲基-2-丙烯
23.(6分)某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1。该有机物可以使溴水褪色,能和金属钠发生反应生成H2,
求:(1)该有机物的摩尔质量 ;
(2)该有机物的分子式 ;
(3)该有机物的结构简式
重庆市垫江师范2007-2008学年下学期期中考试卷
高二化学[实验班]
22、(9分)在离子晶体中,阴、阳离子按一定规律在空间排列, 右图(a)是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构图(b),已知a为常数。
(1)在NaCl晶体中,每个Na+ 同时吸引 个Cl-;与某个Na+距离最近且等距离的Cl-围成的空间几何形状是 ;Na+ 数目和Cl-数目之比为 ;在 Na+周围与它最近且距离相等的 Na+共有 个。
(2)Na+ 半径与Cl-半径之比=
(已知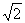 =1.414);
=1.414);
(3)NaCl晶体中不存在分子,但在1.013×105 Pa,1413 ℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25克NaCl晶体,在1.013×105 Pa时强热使温度达到1501.5 ℃,测得气体体积为36.4 L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(不写计算过程) ;
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳
米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子数与总原子数
和比值为 。
(5)若a=5.6×10-8 cm,求NaCl晶体的密度(已知5.6 3=175.6,NaCl的摩尔质量为58.5 g/mol)。
解:
20.(2分)在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取残渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤依次是_______________ (填序号)
(2)鉴定1-氯丙烷中氯元素的操作步骤依次是_________________(填序号)
21(12分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫
酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH
②有关有机物的沸点:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点(℃) |
34.7 |
78.5 |
118 |
77.1 |
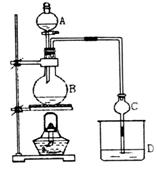 请回答:
请回答:
(1)浓硫酸的作用是 ;若用同位素18O示踪法确定反应产物水分子
中氧原子的提供者,写出能表示18O位置的化学
方程
式 ;
(2)在实验中球形干燥管C除起冷凝蒸气作用外,另一个重要作用是 ,
其原因是 。
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程
式表示) ;
反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出 ;然后在混合液中加入 (此空从下列选项中选择),再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)饱和Na2CO3溶液的作用是 。
19、 (12分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如图所示,已知:A的碳链无支链,且1 mol A能与4 mol Ag(NH3)OH完全反应;B为五元环酯。
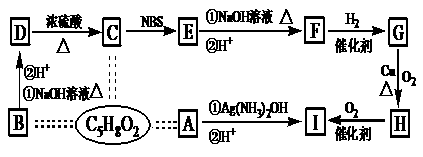
提示:CH3-CH=CH-R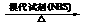 CH2Br-CH=CH-R
CH2Br-CH=CH-R
(1)A中所含官能团是___________________。
(2)B、H结构简式为___________________________、___________________________________。
(3)写出下列反应方程式(有机物用结构简式表示)
D→C___________________________________________________;反应类型
E→F(只写①条件下的反应)______________________________________________。
(4)F的加聚产物的结构简式为______________________________。
(5)配制银氨溶液时,把氨水滴入硝酸银溶液的操作关键是:
_______________________
17(12分)、
Ⅰ(2分).生的绿色苹果与碘变蓝色,这是因为__________________________________;
熟的苹果能与银氨溶液反应,原因是 ___________________________________。
Ⅱ.(6分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
⑴ 已知酸性FCH2COOH>CH3COOH,试推断:
①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)__________。
⑵ 已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:上述三种银盐在水中溶解度由大到小的顺序________________________。
⑶ 除HF外,其他卤化氢沸点随相对分子质量增大而升高,HF的沸点反常的原因是___
_________________________________________________________。
Ⅲ.(每空1分,共4分)教材中学过的不同类的四种有机物,都能燃烧产生等体积的CO2和H2O(气),
(无其它产物),且又都能通过一步反应生成乙醇。请写出它们的结构简式:
⑴ ⑵
⑶ ⑷
18、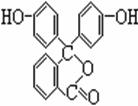 (7分)酚酞是常用的酸碱指示剂,其结构简式如右图
(7分)酚酞是常用的酸碱指示剂,其结构简式如右图
(1)酚酞的化学式为;_____ __。
(2)从结构上酚酞可看做 ________
A.烯烃 B.芳香族化合物 C.醇类物质
D.酚类物质 E. 羧酸类物质 F.酯类物质
(3)酚酞可分别在1 mol·L-1盐酸和1 mol·L-1NaOH溶液中溶解,其中在___ __中的溶解度较大,其原因是______ _ ________________________________。
16.某种高分子化合物的结构简式如图所示:
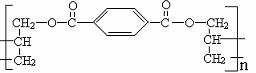
合成它的单体可能有:①对苯二甲酸,②对苯二甲酸甲酯,③丙烯醇,④丙烯,⑤乙烯。其中正确的一组是 ( )
A.①② B.④⑤ C.①③ D.②④
重庆市垫江师范2007-2008学年下学期期中考试卷
 高二化学[实验班]
高二化学[实验班]
高二年级化学试卷成绩统计表(考生不要填写)
第I卷答题栏
第Ⅱ卷(非选择题,共60分)
15、下列化学方程式或离子方程式中正确的是 ( )
A、金属钠加入无水乙醇中:Na + C2H5OH → C2H5ONa + H2↑
B、过量的乙酸跟Na2CO3溶液反应:2H+ + CO32- = H2O + CO2↑
C、溴乙烷在NaOH水溶液中加热:CH3CH2Br + NaOH →CH2=CH2↑+NaBr + H2O
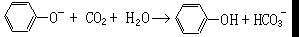 D、苯酚钠溶液中通入CO2:
D、苯酚钠溶液中通入CO2:
14、有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项的事实不能说明上述观点的是 ( )
A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色
B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应
C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂
D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com