
题目列表(包括答案和解析)
25. (8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。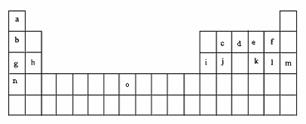
试回答下列问题
(1)元素“O”在周期表中的位置是 。
 (2)画出“c”的简化电子排布式 。
(2)画出“c”的简化电子排布式 。
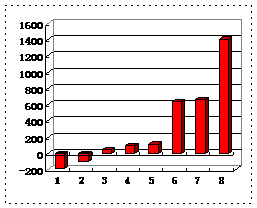
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母,下同),“7”代表 。
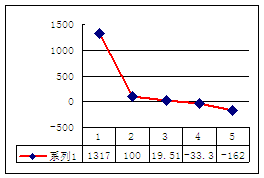
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐
标图如右,序列“5”氢化物的化学式为:
;序列“1”氢化物的电子式为: 。
24.(11分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式 。
⑵NH2-的电子式为 。 ⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 。
⑸等电子数的微粒往往具有相似的结构,试预测N3-的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
23.(5分)A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子
序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电
子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A ;B ;C ;
(2)BC2是由 键组成的 (填“极性”或“非极性”)分子。
22.(12分)已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式____________________、
______________________、____________________、_______________________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是____________元素或 ___________
元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:
_____________________、_______________________、_____________________、
_____________________、_______________________、_____________________。
21.(7分)X原子在第二电子层上只有一个空轨道,则X是 ;其轨道表示式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,是属于 区的元素。
20.(8分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
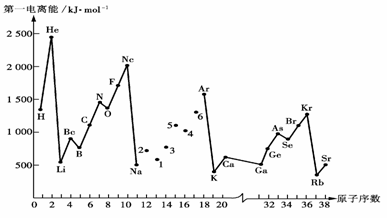
请回答以下问题:
⑴ 认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像。
⑵ 从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________
_____________________________;
⑶ 上图中5号元素在周期表中的位置是_____________、_______________;
⑷ 上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
19.(6分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。
运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出
该反应的化学方程式 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述
氮氢化合物通入足量盐酸时,发生反应的化学方程式
18.据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报
道的认识正确的是
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
第 Ⅱ 卷(非选择题 共57分)
17.下列分子或离子中不能跟质子结合的是
A.NH3 B.H2O
C.Ca2+ D.NH4+
16.下图中,能正确表示基态硅原子的是
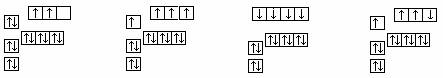
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com