
题目列表(包括答案和解析)
15.⑴ 3CO(g) + Fe2O3(s)== 2Fe (s)+ 3CO2(g) △H == - 24.8KJ/mol
⑵ H2(g) +1/2 O2(g) == H2O(l) △H == - 285.8KJ/mol
22、(12分)在25mL 0.1mol·L-1 盐酸溶液中滴入0.2mol·L-1 NaOH溶液,以酚酞为指示剂。
(1)填写下表中所有空格:(计算结果保留一位小数)
|
①加入NaOH溶液的体积(mL) |
5.0 |
7.5 |
10.7 |
12.0 |
12.3 |
a |
12.8 |
13.0 |
b |
17.5 |
20.0 |
|
②溶液pH |
1.3 |
1.5 |
2.0 |
2.6 |
3.0 |
7.0 |
11.2 |
11.4 |
12.0 |
12.4 |
12.5 |
|
③指示剂的颜色 |
无 |
无 |
无 |
无 |
无 |
粉红 |
红 |
红 |
红 |
红 |
红 |
a mL 、 b mL
(2)根据上表中的数据,在下图格纸中,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。(坐标中pH变化及体积变化要标明)
|
0 5 10 15 20
(3)在实验中,必不可少的玻璃仪器是________________________ _____。
(4)进行中和滴定操作时,眼睛注视__ _
滴定终点的判断依据是__________________________________。
(5)在操作中,锥形瓶用蒸馏水洗净后,未经干燥即进行滴定造成测定结果 _____________填(“偏高”、“偏低”、“无影响”)
21.(8分)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子间可以形成链状结构,氮原子间也可形成链状结构,假设氮、氢原子间只以N-N键或N-H键形式连接,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的NH3对农业、化学和国防工业具有重要意义。其合成原理是:
 N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
N2(g)+3H2(g) 2NH3(g);△H=-92kJ/mol。
①在一定温度下,将1molN2和4molH2气体通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内的压强为起始时的80%。此时反应放出的热量为 。
②保持温度不变,在相同的容器中,将起始时刻物质的量设为amolN2、bmolH2和cmolNH3,欲使平衡时NH3的物质的量分数为25%,则
I.达到平衡时,①与②放出的热量 (填字母)
A.一定相等 B.前者一定小于后者
C.前者等于或小于后者 D.前者等于或大于后者
II.若该反应正向进行,则a的取值范围是 。
20.(6分)在相同条件下进行锌与盐酸、醋酸溶液反应的对照实验,相关数据如下:
|
|
Zn |
酸 的 用 量 |
反 应 速 率 |
产生H2的总量 |
|
Ⅰ |
1.3g |
100mL0.2mol/L盐酸 |
υ1 |
n1 |
|
Ⅱ |
1.3g |
100mL0.2mol/L醋酸溶液 |
υ2 |
n2 |
|
Ⅲ |
1.3g |
100mLc(H+)=0.20mol/L CH3COOH |
υ3 |
n3 |
试比较有关量的大小:
(1)开始反应时速率υ1、υ2、υ3三者的关系: 填(“>”、“<”、“=”,下同)。
(2)产生H2的总量n1 、n2 、n3三者的关系 。
(3)反应开始后一段时间内(反应均未结束)反应速率υ1 υ3。
19.(12分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_______、_______; 杂化轨道分别是________、_________;a分子的立体结构是___________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体:
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________;
(4)Y与Z比较,电负性较大的_________,
Z的+2价离子的核外电子排布式是_______________________。
18.(12分)氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作
 (填代号)
(填代号)
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
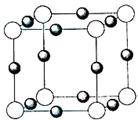
⑷X+中所有电子正好充满KLM三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
17.(10分)原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响。试回答:
⑴ BF3分子的立体结构为 形,NF3 分子的立体结构为 形;
⑵ 碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式) ,存在一个π键的分子是(写名称) ;
⑶ H2O、NH3、CH4分子中键角由大到小的顺序为 ________________ ,原因是 ____________________ ;
⑷ 由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越大、阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。据此,四种卤化银在水中的溶解度由大到小的顺序为 __________________________ 。
16. (6分)将气体A、B置于容积为2L的密闭容器,发生如下反应:
4A(g)+B(g)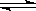 2C(g)反应进行到10S末达到平衡状态时:测得容器内有A为0.6mol,B为0.4mol,C为0.2mol,
2C(g)反应进行到10S末达到平衡状态时:测得容器内有A为0.6mol,B为0.4mol,C为0.2mol,
(1)则vA= _____________ vB= _________________ vC= ______________
(2)反应前A有 ___ mol,反应前B有 _____ mol
⑶达到平衡状态时,A物质的转化率为 。
15. (6分)写出298K时,下列反应的热化学方程式:
⑴用CO(g)还原1mol Fe2O3(s), 生成CO2(g)和Fe(s)放热24.8 KJ.
.
⑵ 2g H2(g)和适量的O2(g)充分反应生成液态水,放出热量285.8KJ.
.
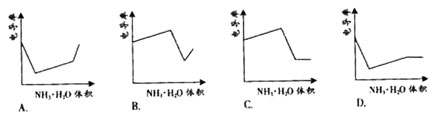
14.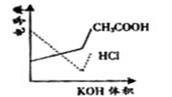 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
第二卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com