
题目列表(包括答案和解析)
23、(12分)
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA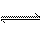 H++A-,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A-,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10- 5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10- 7 K2==5.61×10- 11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10- 8 K2==1.1×10- 12 |
|
H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
K1==7.52×10- 3 K2==6.23×10- 8 K3==2.20×10- 13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
22、(10分)
现有五种化合物,A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+ |
Ba2+ |
Al3+ |
|
阴离子 |
OH- |
Cl- |
SO42- |
为鉴别它们,分别完成以下实验,其结果是:
① B和D都不溶于水,也不溶于酸;
② A溶于水后,与上述某种阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
③ C溶于水后,与上述某种阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
④ E溶于水后,与上述某种阴离子反应可生成B;
⑤ A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A ,C ,D ,E 。
⑵A溶液与过量的E溶液反应后,最终得到的沉淀的化学式是 。
21、(15分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)写出该反应的离子方程式:
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
20、(5分)同温同压下,相同体积的CO和CO2相比较,
(1)它们所含的分子数目之比为:
(2)它们所含的O原子数目之比为:
(3)它们所含的C原子数目之比为:
(4)它们所含的原子总数目之比为:
(5)它们所含的电子数目之比为:
19、(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应
化合反应
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶
液中还可以观察到的现象是
解释此现象的有关离子方程式是
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解
产生Mn2+,该反应的离子方程式是
18.常温下,Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A、Va 一定等于 Vb B、Va 大于或等于 Vb
C、混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D、混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
17、将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:
X(g)+Y(g)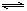 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的体积分数增大
B.增大压强,Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
16、下列各项中指定的比值是2:1的是 ( )
A.C2H4在氧气中充分燃烧生成的CO2、H2O的物质的量之比;
B.K2S溶液中[K+]与[S2-]之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比;
D.16O原子的中子数和质量数之比
15、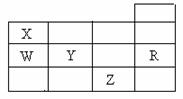 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
14、下列反应的离子方程式书写正确的是 ( )
A.向漂白粉溶液中通入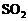 气体:
气体:
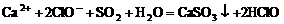
B.溶液中NH4HSO3与NaOH等物质的量混合:
NH4++HSO3-+2OH-=SO32-+NH3·H2O+H2O
C.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
D.足量的溴化亚铁和少量的氯气反应:
2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com