
题目列表(包括答案和解析)
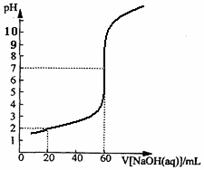
29.(4分)20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如右图所示。
(1)试求X、Y的物质的量浓度之比;
(2)求盐酸的物质的量浓度。
28.(5分)5.8g有机物完全燃烧,只生成CO2和H2O(g),其体积比为1:1(同温同压),若把它们通过碱石灰,碱石灰增重18.6g;等量的该有机物与0.1mol乙酸完全发生酯化反应。又知该有机物相对空气的密度为2。
 (1)通过算出该有机物的分子式
(1)通过算出该有机物的分子式
(2)通过核共振氢谱分析,该有机物共有4个峰,其强度为2︰1︰2︰1,请写出该有机物的结构简式。
27.(8分)资料显示:“铝与空气里的氧气极易反应生成一层致密而坚固的氧化物薄膜,构成薄膜的主要成分是Al2O3,Al2O3的熔点(2050℃)高于Al的熔点(660℃),这层膜起着保护内部金属的作用,使得性质活泼的金属铝成为一种应用广泛的金属材料”。某校化学小组学生为了探究“铝与氧气能否反应”时,做了如下实验:
 (1)用坩埚钳夹住一小块经砂纸打磨过的铝箔在酒精灯火焰上加热,发现铝箔发红蜷缩,变暗失去光泽,但是熔化的铝并不滴落也不燃烧。
(1)用坩埚钳夹住一小块经砂纸打磨过的铝箔在酒精灯火焰上加热,发现铝箔发红蜷缩,变暗失去光泽,但是熔化的铝并不滴落也不燃烧。
(2)将实验作如下改进:将铝箔卷成筒状,内部裹一纸片,铝箔的一端固定在粗铁丝上,点燃纸片,立即伸入装有氧气的集气瓶中(氧气瓶底放有一层细砂,如右图),发现铝箔剧烈燃烧。
回答下列问题:
(1)实验(1)中熔化的铝并不滴落也不燃烧的原因是 ▲ ;
(2)改进实验(2)中纸片的作用是 ▲ ;集气瓶底放有细沙的作用是
▲ 。该实验改进后,铝片能燃烧主要原因是 ▲ 。
26.(6分)下列有关实验的叙述,正确的是(填序号) ▲
A.配制480 mL某物质的量浓度的溶液,可用500mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.能用分液漏斗将甘油和水的混合液体分离
D.用碱式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.用浓硝酸洗涤做过银镜反应的试管
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
H.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
I.在氢氧化铁胶体中加入少量硫酸会产生沉淀
J.用结晶法可以除去硝酸钾中混有的少量氯化钠
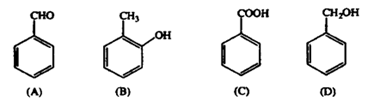
25.(7分)某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2): X+Y Z+H2O
Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应。则X是 ▲ (填标号字母);
(2)Y的分子式是 ▲ ,可能的结构简式是 ▲ 和 ▲ ;
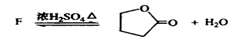 (3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得F(C4H8O3)。F可发生如下反应:
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得F(C4H8O3)。F可发生如下反应:
该反应的类型是 ▲ ,E的结构简式是 ▲ 。
(4)若Y与E具有相同的碳链,则Z的结构简式为 ▲ 。
24.(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
 (1)Z2Y的化学式是 ▲ 。
(1)Z2Y的化学式是 ▲ 。
(2)Z2Y2与X2Y反应的化学方程式是 ▲ 。
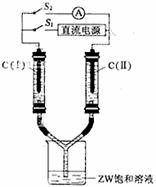
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 ▲ (填写正极或负极),
C(II)的电极反应式是 ▲ ;
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 ▲ 。
23.(6分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)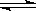 2HI(g);ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g);ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 ▲ ;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ▲ ;
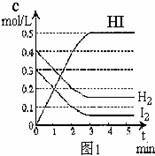
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变) ▲ ,HI浓度的变化正确 ▲ ;(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ▲ 。(用图2中d-f的编号回答)
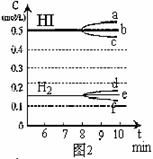
(4)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
22.(8分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH。已知:CO2+3H2O+2AlO2-== 2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是 ▲ (填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 ▲ (填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是 ▲ (填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 ▲ 。
21.(6分)写出下列反应的化学方程式或离子方程式(能写离子方程式的必须写离子方程式)
(1)铝与氢氧化钠溶液的反应 ▲ ;
(2)用明矾净化水 ▲ ;
(3)实验室制乙烯 ▲ 。
20、向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH= 4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。其平衡关系如下:

向0.05 mol·L-1的Cr2(SO4)3溶液50mL中,加入1.0 mol·L-1的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀 C.溶液为亮绿色 D.无法判断
第Ⅱ卷(非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com