
题目列表(包括答案和解析)
10.A、B、C是三种金属,根据下列①②两个实验,确定它们的还原性强弱顺序为:①将A 与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)
A.A>B>C B.B>C>A C.C>A>B D.B>A>C
9.在平衡体系Ca(OH)2(s)
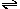 Ca2++2OH
-中,能使c(Ca2+)减小,而使c(OH
-)增大的是:
Ca2++2OH
-中,能使c(Ca2+)减小,而使c(OH
-)增大的是:
A.加入少量MgCl2固体 B.加入少量Na2CO3固体
C.加入少量KCl固体 D.加入少量Ca(OH)2固体
8.把AlCl3溶液蒸干灼烧,最后得到的固体产物是
A.AlCl3·6H2O B.AlCl3 C.Al(OH)3 D.Al2O3
7.在下列实验方法中,不能证明醋酸是弱酸的是
A.25℃时,醋酸钠溶液呈碱性
B.25℃时,0.1 mol/L的醋酸的pH约为3
C.25℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D.25℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水量多
6.在一定温度下,将物质的量都为2 mol的A和B充入一密闭容器中,发生如下反应:
A(g)+2B(g) 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
A.30% B.40% C.50% D.80%
5.在一定温度下可逆反应H2(g)+I2(g)
 2HI(g) 达到平衡的标志是
2HI(g) 达到平衡的标志是
A.有1mol H-H键断裂,同时有1 mol I-I键形成
B.容器内压强不再随时间而变化
C.单位时间内反应掉n mol I2 同时生成2n mol HI
D.H2、I2、HI的浓度之比为1∶1∶2
4.下列说法正确的是
A.KW随浓度的改变而改变
B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D.一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱
3.下列说法正确的是
A.放热反应一定都是自发的 B.电解池的反应属于自发过程
C.反应能否自发进行与温度有关 D.能自发进行的化学反应,一定是△H>0、△S>0
2.下列分离提纯方法不正确的是
A.分离KNO3和氯化钠,常用结晶与重结晶 B.提纯含有碘的食盐,常用升华法
C.去除乙醇中的水分离常用蒸馏法 D.苯和酸性高锰酸钾溶液可用分液法
1.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com